
Cycloalkines egenskaber, anvendelser, eksempler
Det cycloalkiner De er organiske forbindelser, der har en eller flere tredobbelte bindinger og en cyklisk enhed. Dens kondenserede molekylformler overholder formlen CnH2n-4. Således, hvis n er lig med 3, vil formlen af cycloalkinen være C3Hto.
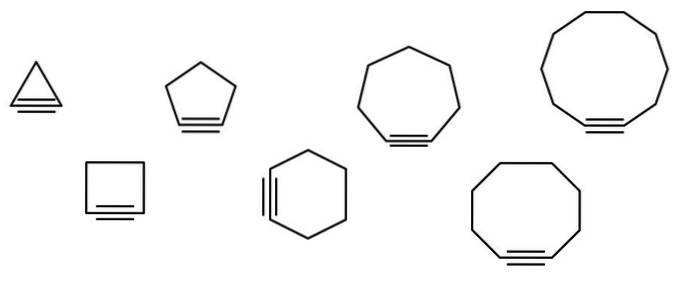
En række geometriske figurer er illustreret i nedenstående billede, men de består faktisk af eksempler på cycloalkiner. Hver af dem kan betragtes som en mere oxideret version af de respektive cycloalkaner (uden dobbelt- eller tredobbeltbindinger). Når de mangler et heteroatom (O, N, S, F osv.), Er de kun "enkle" carbonhydrider..
Kemien omkring cycloalkiner er meget kompleks, og mekanismerne bag deres reaktioner er endnu mere komplekse. De repræsenterer et udgangspunkt for syntesen af mange organiske forbindelser, som igen er underlagt mulige anvendelser.
Generelt er de meget reaktive, medmindre de er "forvrængede" eller sammensatte med overgangsmetaller. Ligeledes kan dens tredobbelte bindinger konjugeres med dobbeltbindinger, hvilket skaber cykliske enheder i molekylerne..
Hvis dette ikke er tilfældet, er de i deres enkleste strukturer i stand til at tilføje små molekyler til deres tredobbelte bindinger..
Artikelindeks
- 1 Kendetegn ved cycloalkiner
- 1.1 Apolaritet og tredobbelt binding
- 1.2 Intermolekylære kræfter
- 1.3 Vinklet stress
- 2 Nomenklatur
- 3 applikationer
- 4 eksempler
- 5 Referencer
Karakteristik af cycloalkiner
Apolaritet og tredobbelt bånd
Cycloalkiner er karakteriseret ved at være apolære molekyler og derfor hydrofobe. Dette kan ændre sig, hvis de i deres strukturer har en eller anden heteroatom eller funktionel gruppe, der giver dem et betydeligt dipolmoment; som det sker i heterocykler med tredobbelte bindinger.
Men hvad er et tredobbelt bånd? De er ikke mere end tre samtidige interaktioner mellem to carbonatomer med sp-hybridisering. Den ene binding er enkel (σ), og de andre to π, vinkelret på hinanden. Begge kulstofatomer har en fri sp-orbital til at binde til andre atomer (R-C≡C-R).
Disse hybrid orbitaler er 50% s karakter og 50% p karakter. Fordi s orbitaler er mere gennemtrængende end p, gør denne kendsgerning de to carbonatomer i den tredobbelte binding surere (elektronacceptorer) end kulstofferne i alkanerne eller alkenerne..
Af denne grund repræsenterer den tredobbelte binding (≡) et specifikt punkt for elektrondonearter at tilføje til det og danner enkeltbindinger..
Dette resulterer i brud på en af π-bindingerne og bliver en dobbeltbinding (C = C). Tilsætningen fortsætter indtil R4C-CR4, dvs. fuldt mættede kulstoffer.
Ovenstående kan også forklares på denne måde: den tredobbelte binding er en dobbelt umætning.
Intermolekylære kræfter
Cycloalkinemolekyler interagerer gennem spredningskræfter eller London-kræfter og ved interaktioner af π-π-typen. Disse interaktioner er svage, men når cyklernes størrelse øges (som de sidste tre på højre side af billedet), formår de at danne faste stoffer ved stuetemperatur og tryk..
Vinklet stress
Bindingerne i den tredobbelte binding er placeret på samme plan og en linje. Derfor har -C≡C- en lineær geometri, hvor sp-orbitalerne er adskilt med ca. 180º.
Dette har en alvorlig betydning for den stereokemiske stabilitet af cycloalkiner. Det tager meget energi at "bøje" sp-orbitalerne, da de ikke er fleksible.
Jo mindre cycloalkinen er, jo mere skal sp-orbitalerne bøjes for at muliggøre dens fysiske eksistens. Ved at analysere billedet kan det ses fra venstre mod højre, at i trekanten er vinklen af bindingerne til siderne af den tredobbelte binding meget udtalt; mens de er i decagon er de mindre stejle.
Jo større cycloalkinen er, jo tættere er båndvinklen på sp-orbitalerne den ideelle 180º. Det modsatte opstår, når de er mindre, hvilket tvinger dem til at bøje og skabe en vinklet stress i dem destabiliserende cycloalkinen.
Således har de større cycloalkiner lavere vinkelspænding, hvilket muliggør deres syntese og opbevaring. Med dette er trekanten den mest ustabile cycloalkin, og dekagonen den mest stabile af dem alle..
Faktisk er cyclooctino (den med ottekant) den mindste og mest stabile kendte størrelse; de andre eksisterer kun som midlertidige mellemled i kemiske reaktioner.
Nomenklatur
De samme IUPAC-standarder som for cycloalkaner og cycloalkener skal anvendes til navngivning af cycloalkiner. Den eneste forskel ligger i suffikset -ico i slutningen af navnet på den organiske forbindelse..
Hovedkæden er den, der har den tredobbelte binding, og begynder at blive nummereret fra slutningen tættest på den. Hvis du for eksempel har cyclopropan, kaldes det at have en tredobbelt binding cyclopropino (trekanten på billedet). Hvis en methylgruppe er knyttet til det øverste toppunkt, vil det være: 2-methylcyclopropino.
Kulstofferne i R-C≡C-R har allerede deres fire bindinger, så det mangler hydrogener (som det er tilfældet med alle cycloalkiner i billedet). Dette sker ikke kun, hvis den tredobbelte binding er i en terminal position, det vil sige i slutningen af en kæde (R-C≡C-H).
Ansøgninger
Cycloalkiner er ikke særlig almindelige forbindelser, så heller ikke deres anvendelser. De kan tjene som bindemidler (grupper, der koordinerer) til overgangsmetaller og derved skabe en uendelig mængde organometalliske forbindelser, der kan bruges til meget strenge og specifikke anvendelser..
De er generelt opløsningsmidler i deres mest mættede og stabile former. Når de består af heterocykler, ud over at have interne C2C-C = C-C2C cykliske enheder, finder de interessante og lovende anvendelser som anticancermedicin; Sådan er tilfældet med Dinemycin A. Andre forbindelser med strukturelle analogier er blevet syntetiseret ud fra det..
Eksempler
Billedet viser syv enkle cycloalkiner, hvor der næppe er en tredobbelt binding. Fra venstre mod højre med deres respektive navne er der: cyclopropino, trekanten; cyclobutino, firkanten; cyclopentin, pentagonen; cyclohexin, sekskanten; cycloheptin, heptagonen; cyclooctino, ottekantet; og cyclodecino, decagon.
Baseret på disse strukturer og erstatning af hydrogenatomer i de mættede carbonatomer, kan andre forbindelser afledt deraf opnås. De kan også udsættes for oxidative betingelser for at danne dobbeltbindinger på andre sider af cyklusser..
Disse geometriske enheder kan være en del af en større struktur, hvilket øger chancerne for at funktionalisere hele sættet. Der er ikke mange eksempler på cycloalkiner, i det mindste ikke uden at fordybe sig i de dybe riger inden for organisk syntese og farmakologi..
Referencer
- Francis A. Carey. Organisk kemi. (Sjette udgave, s. 372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cycloalkyne. Hentet fra: en.wikipedia.org
- William Reusch. (5. maj 2013). Navngivning af organiske forbindelser. Hentet fra: 2.chemistry.msu.edu
- Uorganisk kemi. Cycloalkiner. Hentet fra: fullquimica.com
- Patrizia Diana & Girolamo Cirrincione. (2015). Biosyntese af heterocykler fra isolering til genklynge. Wiley, side 181.
- Interessant organisk kemi og naturlige produkter. (2015, 17. april). Cycloalkynes. Hentet fra: quintus.mickel.ch


Endnu ingen kommentarer