
Cyclopentan (C5H10) struktur, egenskaber og anvendelser
Det cyclopentan det er et cyklisk carbonhydrid, specifikt en cycloalkan. Til gengæld er det en organisk forbindelse, hvis molekylære formel er C5H10. Det kan ses som den lukkede version af n-pentan, åben kæde, hvor dens ender er blevet forbundet med tabet af to hydrogenatomer.
Det nederste billede viser skelettet af cyclopentan. Læg mærke til, hvor geometrisk dets skelet ser ud og danne en femkantet ring. Imidlertid er dens molekylære struktur ikke flad, men præsenterer snarere folder, der søger at stabilisere og reducere spændingen i ringen. Cyclopentan er en meget flygtig og brandfarlig væske, men ikke så brandfarlig som n-pentan.
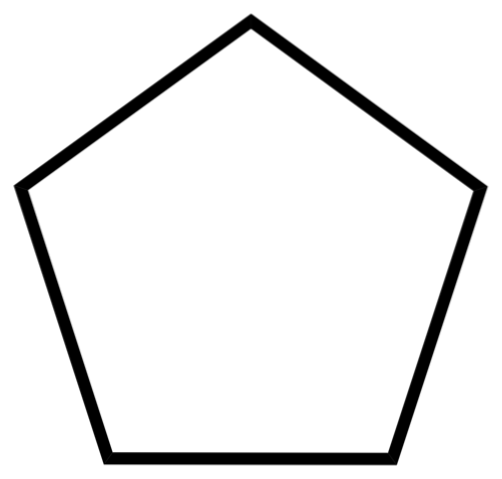
På grund af dets opløsningsmiddelkapacitet er cyclopentan et af de mest anvendte opløsningsmidler i den kemiske industri. Det er ikke overraskende, at mange produkter med stærk lugt indeholder det blandt deres sammensætning og derfor er brandfarlige. Det bruges også som et blæsemiddel til polyurethanskum, der anvendes i køleskabe..
Artikelindeks
- 1 Struktur af cyclipentan
- 1.1 Intermolekylære interaktioner
- 1.2 Konformationer og ringspænding
- 2 Egenskaber for cyclipentan
- 2.1 Fysisk udseende
- 2.2 Molær masse
- 2.3 Smeltepunkt
- 2.4 Kogepunkt
- 2.5 Flammepunkt
- 2.6 Selvantændelsestemperatur
- 2.7 Fordampningsvarme
- 2.8 Viskositet
- 2.9 Brydningsindeks
- 2.10 Damptryk
- 2.11 Tæthed
- 2.12 Opløselighed
- 2.13 Fordelingskoefficient for Octanol / vand
- 2.14 Reaktivitet
- 3 anvendelser
- 3.1 Industrielt opløsningsmiddel
- 3.2 Ethylenkilde
- 3.3 Isolerende polyurethanskum
- 4 Referencer
Struktur af cyclipentan
Intermolekylære interaktioner
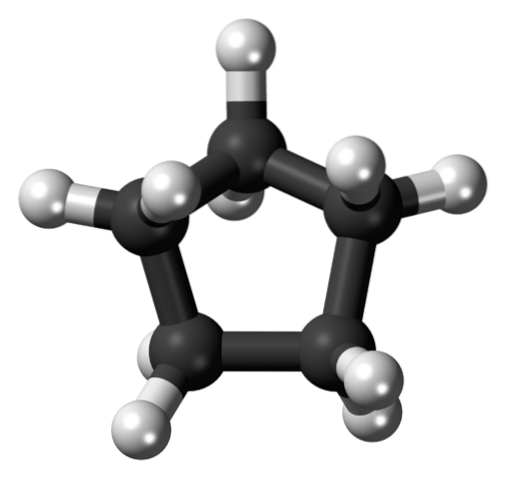
I det første billede blev cyclopentanskelet vist. Ovenfor ser vi nu, at det er mere end en simpel femkant: brintatomer (hvide kugler) stikker ud ved dets kanter, mens kulstofatomer udgør den femkantede ring (sorte kugler).
Ved kun at have C-C og CH-bindinger er deres dipolmoment ubetydelig, så cyclopentanmolekyler kan ikke interagere med hinanden gennem dipol-dipolkræfter. I stedet holdes de sammen takket være Londons spredte kræfter, hvor ringene forsøger at stable oven på hinanden..
Denne stabling tilbyder noget kontaktareal, der er større end det tilgængelige mellem lineære molekyler af n-pentan. Som et resultat af dette har cyclopentan et højere kogepunkt end n-pentan såvel som et lavere damptryk.
Dispergeringskræfter er ansvarlige for, at cyclopentan danner en molekylær krystal, når den nedfryses ved -94 ° C. Selvom der ikke er meget information om dens krystallinske struktur, er den polymorf og har tre faser: I, II og III, hvor fase II er en uordnet blanding af I og III.
Konformationer og ringspænding
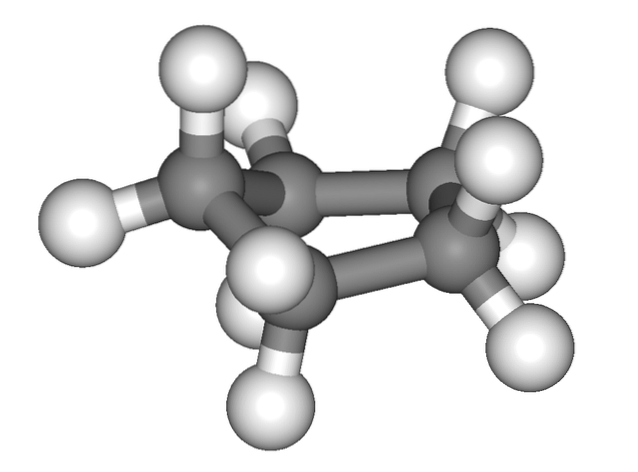
Billedet ovenfor giver det falske indtryk af, at cyclopentan er fladt; men det er ikke sådan. Alle dets carbonatomer har SP-hybridisering3, så deres orbitaler er ikke i samme plan. Også som om dette ikke var nok, er hydrogenatomer meget tæt på hinanden, stærkt frastødt, når de er overskygget..
Således taler vi om konformationer, hvoraf den ene er halvstolen (øverste billede). Fra dette perspektiv forstås det klart, at cyclopentanringen har bøjninger, hvilket hjælper med at reducere dens ringspænding på grund af dens carbonatomer så tæt på hinanden..
Denne spænding skyldes, at C-C-bindingerne har vinkler, der er mindre end 109,5 °, den ideelle værdi for det tetraedriske miljø som et resultat af deres sp-hybridiseringer.3.
På trods af denne stress er cyclopentan imidlertid en mere stabil og mindre brandfarlig forbindelse end pentan. Dette kan verificeres ved at sammenligne deres sikkerhedsdiamanter, hvor cyclopentans antændelighed er 3, mens den for pentan, 4.
Egenskaber for cyclipentan
Fysisk fremtoning
Farveløs væske med en mild petroleumlignende lugt.
Molar masse
70,1 g / mol
Smeltepunkt
-93,9 ºC
Kogepunkt
49,2 ºC
Flammepunkt
-37,2 ºC
Selvantændelsestemperatur
361 ºC
Fordampningsvarme
28,52 kJ / mol ved 25 ºC
Viskositet
0,413 mPa s
Brydningsindeks
1.4065
Damptryk
45 kPa ved 20 ° C. Dette tryk svarer til ca. 440 atm, dog lavere end for n-Pentan: 57,90 kPa.
Her manifesteres effekten af strukturen: cyclopentanringen tillader mere effektive intermolekylære interaktioner, som binder og bibeholder mere sine molekyler i væsken sammenlignet med de lineære molekyler i n-pentan. Derfor har sidstnævnte et højere damptryk.
Massefylde
0,751 g / cm3 ved 20 ° C. På den anden side er dens dampe 2,42 gange tættere end luft.
Opløselighed
I en liter vand ved 25 ° C opløses kun 156 mg cyclopentan på grund af dets hydrofobe natur. Det er imidlertid blandbart i ikke-polære opløsningsmidler, såsom andre paraffiner, ethere, benzen, carbontetrachlorid, acetone og ethanol..
Fordelingskoefficient for oktanol / vand
3
Reaktivitet
Cyclopentan er stabil, når den opbevares korrekt. Det er ikke et reaktivt stof, fordi dets C-H- og C-C-bindinger ikke er lette at bryde, selvom det ville føre til frigivelse af energi forårsaget af ringens spænding.
I nærvær af ilt vil det brænde i en forbrændingsreaktion, hvad enten det er komplet eller ufuldstændigt. Da cyclopentan er en meget flygtig forbindelse, skal den opbevares på steder, hvor den ikke kan udsættes for nogen varmekilde..
I mellemtiden vil cyclopentan i fravær af ilt gennemgå en pyrolysereaktion, der nedbrydes til mindre og umættede molekyler. En af dem er 1-penten, hvilket viser, at varmen bryder cyclopentanringen for at producere en alken.
På den anden side kan cyclopentan reagere med brom under ultraviolet stråling. På denne måde erstattes en af dens CH-obligationer med C-Br, som igen kan erstattes af andre grupper; og således opstår cyclopentanderivater.
Ansøgninger
Industrielt opløsningsmiddel
Den hydrofobe og apolære karakter af cyclopentan gør det til et affedtningsopløsningsmiddel sammen med andre paraffiniske opløsningsmidler. På grund af dette er det normalt en del af formuleringerne af mange produkter, såsom lim, syntetiske harpikser, maling, klæbemidler, tobak og benzin..
Ethylenkilde
Når cyclopentan udsættes for pyrolyse, er et af de vigtigste stoffer, det genererer, ethylen, som har utallige anvendelser i verden af polymerer..
Isolerende polyurethanskum
En af de mest bemærkelsesværdige anvendelser af cyclopentan er som et opblæsningsmiddel til fremstilling af isolerende polyurethanskum; dvs. cyclopentandampe på grund af deres høje tryk udvider det polymere materiale, indtil det danner et skum med fordelagtige egenskaber, der skal bruges i rammen af køleskabe eller frysere.
Nogle virksomheder har valgt at erstatte cyclopentan med HFC'er til fremstilling af isoleringsmaterialer, da det ikke bidrager til forringelsen af ozonlaget og også reducerer frigivelsen af drivhusgasser i miljøet.
Referencer
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. (10th udgave.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Wikipedia. (2020). Cyclopentan. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Cyclopentan. PubChem-database, CID = 9253. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Cyclopentan. ScienceDirect. Gendannet fra: sciencedirect.com
- GE apparater. (2011, 11. januar). Reduktion af drivhusgasemissioner ved GE's køleskabsproduktionsfaciliteter. Gendannet fra: pressroom.geappliances.com



Endnu ingen kommentarer