
Arsenesyre (H3AsO3) egenskaber, risici og anvendelser
Det arsenøs syre det er en uorganisk forbindelse med formlen H3AsO3. Dens struktur er analog med trihydroxyamin og kan omskrives som As (OH) 3. Det er i vandig form, og det har ikke været muligt at isolere det i ren fast tilstand. Dens struktur er vist i figur 1.
Udarbejdelsen af As (OH) 3 medfører en langsom hydrolyse af arsentrioxid i vand. Summen af basen omdanner arsenøs syre til arsenitionerne: [AsO (OH) 2] -, [AsO2 (OH)] 2- og [AsO3] 3-.
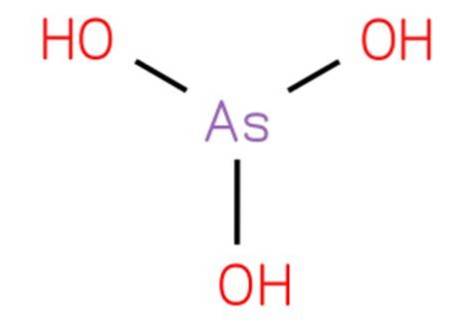
Det er en svag syre. Reaktioner, der tilskrives vandig arsentrioxid, skyldes arseninsyre og dens konjugerede baser.
Artikelindeks
- 1 Fysiske og kemiske egenskaber af arsenøs syre
- 2 Reaktivitet og farer
- 2.1 I tilfælde af kontakt med øjnene
- 2.2 I tilfælde af hudkontakt
- 2.3 I tilfælde af indtagelse
- 2.4 I tilfælde af indånding
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber af arsenøs syre
Arsenøs syre er et pyramidemolekyle, der består af tre hydroxylgrupper bundet til arsen. 1H NMR-spektret af arseninsyreopløsninger består af et enkelt signal, der er i overensstemmelse med den høje symmetri af molekylet. Eksisterer kun i vandig opløsning.
Nævnte opløsning er farveløs og har ingen karakteristisk aroma. Det opbevares i ravbeholdere for at undgå reaktion med UV-stråling (National Center for Biotechnology Information, 2017).

Dens molekylvægt er 125,94 g / mol. Selvom forbindelsen ikke er isoleret, er dens egenskaber beregnet ved hjælp af beregningsmetoder (© Royal Society of Chemistry, 2015) for at opnå, at den har et smeltepunkt på 271,52 ° C, et kogepunkt på 626,14 ° C og en vandopløselighed på 1 x 106 mg / l ved 25 ° C.
Forbindelsen har en pKa på 9,2 til reaktionen:
H3AsO3 ⇌ H2AsO3- + H+
Litteraturen rapporterer, at forbindelsen har en amfoterisk karakter, skønt den dissocieres som en base i mindre grad end den dissocierer som en syre, hvor basen har en pKb på 14 til reaktionen:
As (OH) 3 ⇌ As (OH) 2+ + OH-
Dette fører til dannelse af arter såsom sure arsenhydroxidsulfater (As (OH) (HSO4) +, As (OH) 2 (HSO4)) i koncentrerede opløsninger af svovlsyre eller til dannelsen af arseninsyresulfat (As (HSO4) ) 3) i røgende svovlsyreopløsninger.
Arsen syre kan fungere som et oxidationsmiddel eller et reduktionsmiddel og forblive henholdsvis elementær arsen eller arsen i henhold til halvreaktionerne:
H3AsO3 + 3H + + 3e- → As + 3 H2O (ξ0 = +0.240 V)
H3AsO3 + H2O → H3AsO4 + 2H + + 2e- (ξ0 = -0,560 V)
Arsenisk syre er et stærkere oxidationsmiddel end dets phosphonmodstykke, men et svagere reduktionsmiddel end det (Egon Wiberg, 2001).
Reaktivitet og farer
Arsen syre er en forbindelse klassificeret som stabil, men det er et giftigt og ætsende reagens.
Forbindelsen har en ubetydelig brand- og eksplosionsfare, når den udsættes for varme eller ild. I dette tilfælde skal beholderen flyttes, hvis det er muligt, undgå indånding af dampe eller støv..
Ved opvarmning frigiver forbindelsen giftige og ætsende dampe af arsenoxid. Selvstændigt åndedrætsværn og beskyttelsesdragt bør bæres for at undgå kontakt i tilfælde af brand.
Det kan irritere øjnene, huden og slimhinden. Kan give overfølsomhed. Forgiftning kan påvirke centralnervesystemet, gastrointestinale og kardiovaskulære systemer, lever og nyrer. Forbindelser indeholdende arsen er meget giftige og kræftfremkaldende.
I tilfælde af kontakt med øjnene
Vask med rigeligt vand i mindst 15 minutter, og løft øjenlågene lejlighedsvis, indtil der ikke er tegn på kemiske rester.
I tilfælde af hudkontakt
Vask straks med rigeligt sæbe og vand i mindst 15 minutter, mens du fjerner forurenet tøj og sko. Forbrændinger er dækket med et tørt sterilt bandage (sikkert, ikke tæt).
I tilfælde af indtagelse
Store mængder vand skal gives til det bevidste offer for at fortynde syren. Brug ikke gastrisk skylning eller fremkald opkastning. Medicinsk personale skal vedligeholde luftveje og vejrtrækning.
I tilfælde af indånding
Hvis det er nødvendigt, skal kunstig åndedræt gives. Flyt offeret til et køligt sted, og hold det varmt og i ro.
I alle tilfælde bør der straks søges lægehjælp (Sikkerhedsdatablad Arsenious acid solution, 2007).
Ansøgninger
Arsenisk syre bruges til at detektere små mængder af iod eller iodforbindelser. I arbejdet med (Weegh, 1972) blev nogle aspekter af den ceriske reaktion af arseninsyre undersøgt, idet de optiske egenskaber ved ceriske opløsninger blev taget hensyn..
De kinetiske virkninger af forskellige forbindelser blev også undersøgt, især virkningerne af chlorid og bromidioner og de kinetiske virkninger af chlorid eller bromid i kombination med iodid..
Arsen syre kan også anvendes ulovligt til at forårsage aborter (Trend, 1858).
Arsen syre reagerer, når den opvarmes til dannelse af arsen trioxid (As2O3). Denne forbindelse er også almindeligt kendt under navnet arsen syre på trods af at den ikke er den samme forbindelse. Strukturen af arsentrioxid er vist i figur 3.
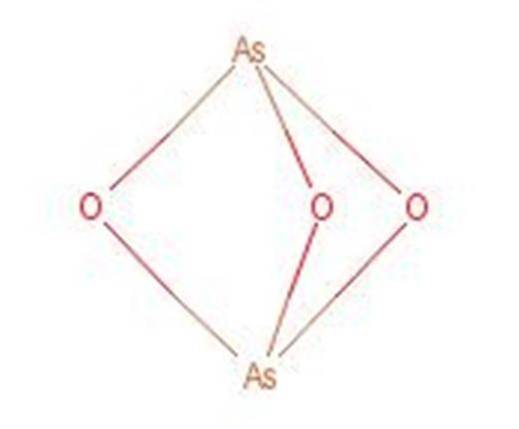
Figur 1: Struktur af arsentrioxid.
Denne forbindelse, også kendt som Trisenox, anvendes til behandling af leukæmipatienter, der ikke har reageret på andre stoffer. Denne medicin er godkendt til brug af US Food and Drug Administration (FDA) som en behandling for leukæmi..
Hvordan forbindelsen fungerer, er uklar. Det kan forårsage morfologiske ændringer og DNA-fragmentering i promyelocytiske leukæmiceller, der forårsager celledød og nedbrydning eller beskadigelse af PML / RAR alpha (et fusionsprotein) (Nurse's Drug Handbook 7. udgave, 2013).
At være giftig for menneskekroppen, er det et af de meget diskutable stoffer i marken. Arsen trioxid blev først brugt som en traditionel kinesisk medicin kaldet Pi Shuang. Det bruges stadig i dag til behandling af kræftpatienter og andre sundhedsmæssige forhold. (Arsenious acid review, 2007-2016).
Referencer
- © Royal Society of Chemistry. (2015). Arsenøs syre. Gendannet fra chemspider.
- © Royal Society of Chemistry. (2015). Trihydroxyamin. Gendannet fra chemspider.
- Arsenisk syre anmeldelse. (2007-2016). Gendannet fra medicalook.
- Arsenøs syre. (2014, 28. juli). Gendannet fra ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Uorganisk kemi. Berlin: akademisk presse.
- Sikkerhedsdatablad Arsenøs syreopløsning. (2007, 10. september). Gendannet fra t3db.ca.
- National Center for Biotechnology Information. (2017, 4. marts). PubChem Compound Database; CID = 545,. Hentet fra PubChem.
- Nurse's Drug Handbook 7. udgave. (2013). McGraw-Hill.
- Trend, H. G. (1858). Et tilfælde, hvor alvorlig syre blev brugt til at skaffe abort. britiske medicinske journal originale kommunikationer, 725-726.
- Weegh, W. H. (1972). Anvendelsen af cerium-arsen-syrereaktionen til bestemmelse af små mængder iod- eller iodforbindelser. Clinica Chimica Acta bind 39, udgave 2, 327-338.


Endnu ingen kommentarer