
Benzoesyre struktur, egenskaber, produktion, anvendelser
Det benzoesyre er den enkleste aromatiske syre af alle med molekylformel C6H5COOH. Det skylder sit navn det faktum, at det i lang tid havde benzoin som hovedkilde, en harpiks opnået fra barken fra flere træer af slægten Styrax..
Det findes i mange planter, især frugter, såsom abrikoser og blåbær. Det produceres også i bakterier som et biprodukt af metabolismen af aminosyren phenylalanin. Det genereres også i tarmen ved bakteriel (oxidativ) behandling af polyphenoler til stede i nogle fødevarer..

Som det kan ses på billedet ovenfor, er C6H5COOH er, i modsætning til mange syrer, en fast forbindelse. Dens faste stof består af lyse, hvide og filiforme krystaller, der afgiver en mandelaroma.
Disse nåle har været kendt siden det 16. århundrede; for eksempel beskriver Nostradamus i 1556 sin tørdestillation fra benzoingummi.
En af de vigtigste kapaciteter af benzoesyre er at hæmme væksten af gær, skimmel og nogle bakterier; som det bruges som et fødevarekonserveringsmiddel. Denne handling er pH-afhængig.
Benzoesyre har flere medicinske virkninger, der bruges som en komponent i farmaceutiske produkter, der anvendes til behandling af hudsygdomme såsom ringorm og fodsvamp. Det bruges også som et inhalant aflastningsmiddel, slimløsende og smertestillende middel.
En høj andel industrielt produceret benzoesyre er bestemt til produktion af phenol. En del af det er ligeledes bestemt til produktion af glycolbenzoater, der anvendes til fremstilling af blødgørere..
Selvom benzoesyre ikke er en særlig giftig forbindelse, har den nogle sundhedsskadelige virkninger. Af denne grund anbefaler WHO en maksimal indtagelsesdosis på 5 mg / kg legemsvægt / dag, hvilket svarer til et dagligt indtag på 300 mg benzoesyre..
Artikelindeks
- 1 Struktur af benzoesyre
- 1.1 Krystal- og hydrogenbindinger
- 2 Fysiske og kemiske egenskaber
- 2.1 Kemiske navne
- 2.2 Molekylær formel
- 2.3 Molekylvægt
- 2.4 Fysisk beskrivelse
- 2,5 Lugt
- 2.6 Smag
- 2.7 Kogepunkt
- 2.8 Smeltepunkt
- 2.9 Flammepunkt
- 2.10 Sublimering
- 2.11 Opløselighed i vand
- 2.12 Opløselighed i organiske opløsningsmidler
- 2.13 Tæthed
- 2.14 Dampmassefylde
- 2.15 Damptryk
- 2.16 Stabilitet
- 2.17 Nedbrydning
- 2.18 Viskositet
- 2.19 Forbrændingsvarme
- 2.20 Fordampningsvarme
- 2,21 pH
- 2.22 Overfladespænding
- 2,23 pKa
- 2.24 Brydningsindeks
- 2.25 Reaktioner
- 3 Produktion
- 4 anvendelser
- 4.1 Industriel
- 4.2 Lægemidler
- 4.3 Konservering af fødevarer
- 4.4 Andre
- 5 Toksicitet
- 6 Referencer
Struktur af benzoesyre
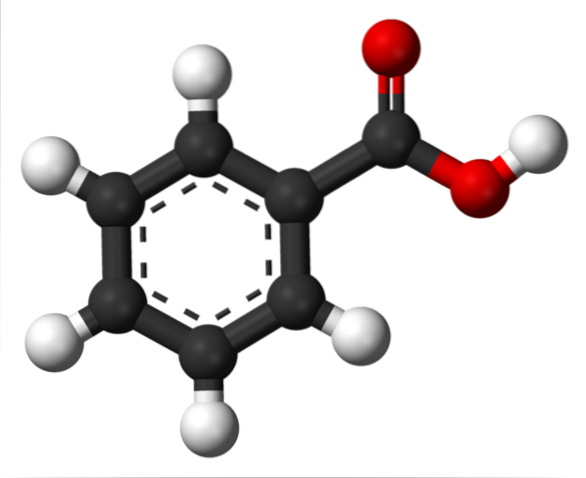
I det øverste billede er strukturen af benzoesyre repræsenteret med en model af søjler og kugler. Hvis antallet af sorte kugler tælles, vil det blive bekræftet, at der er seks af dem, det vil sige seks kulstofatomer; to røde kugler svarer til de to oxygenatomer i carboxylgruppen, -COOH; og til sidst er de hvide kugler hydrogenatomer.
Som det kan ses, er den aromatiske ring til venstre, hvis aromatisering er illustreret med de brudte linjer i midten af ringen. Og til højre gruppen -COOH, der er ansvarlig for de sure egenskaber ved denne forbindelse.
Molekylært er C6H5COOH har en flad struktur på grund af det faktum, at alle dets atomer (med undtagelse af hydrogener) har sp-hybridiseringto.
På den anden side tillader den stærkt polære -COOH-gruppe en permanent dipol at eksistere i strukturen; dipol, der kunne ses ved første øjekast, hvis dets elektrostatiske potentialekort var tilgængeligt.
Denne kendsgerning har som konsekvens, at C6H5COOH kan interagere med sig selv gennem dipol-dipol kræfter; specifikt med de specielle hydrogenbindinger.
Hvis du ser på -COOH-gruppen, vil du opdage, at iltet i C = O kan acceptere en hydrogenbinding; mens ilt fra O-H donerer dem.
Krystal- og hydrogenbindinger
Benzoesyre kan danne to hydrogenbindinger: den modtager og accepterer en samtidigt. Derfor danner den dimerer; det vil sige, dets molekyle er "relateret" til et andet.
Er disse par eller dimerer, C6H5COOH-HOOCC6H5, den strukturelle base, der definerer det faste stof som følge af dets placering i rummet.
Disse dimerer udgør et plan af molekyler, der på grund af deres stærke og retningsbestemte interaktioner formår at etablere et ordnet mønster i det faste stof. Aromatiske ringe deltager også i denne rækkefølge gennem interaktioner af spredningskræfter..
Som et resultat bygger molekylerne en monoklinisk krystal, hvis nøjagtige strukturelle egenskaber kan studeres ved hjælp af instrumentelle teknikker, såsom røntgendiffraktion..
Det er herfra, at et par flade molekyler kan arrangeres i rummet, overvejende ved hydrogenbinding, for at give anledning til de hvide og krystallinske nåle..
Fysiske og kemiske egenskaber
Kemiske navne
Syre:
-benzoesyre
-carboxylbenzen
-dracylic
-carboxybenzen
-benzenoform
Molekylær formel
C7H6ELLERto eller C6H5COOH.
Molekylær vægt
122,123 g / mol.
Fysisk beskrivelse
Fast eller i form af krystaller, normalt hvide i farve, men kan være beige i farve, hvis det har visse urenheder. Dens krystaller er skællede eller nåleformede (se første billede).
Lugt
Det lugter af mandler og er behageligt.
Smag
Smagløs eller lidt bitter. Grænse til detektering af smag er 85 ppm.
Kogepunkt
480ºF til 760mmHg (249ºC).
Smeltepunkt
252,3 º F (121,5 - 123,5 ºC).
antændelsespunkt
121ºC (250 ºF).
Sublimering
Det kan sublimere fra 100 ºC.
Vandopløselighed
3,4 g / L ved 25 ºC.
Opløselighed i organiske opløsningsmidler
-1 g benzoesyre opløses i et volumen svarende til: 2,3 ml kold alkohol; 4,5 ml chloroform; 3 ml ether; 3 ml acetone; 30 ml carbontetrachlorid; 10 ml benzen; 30 ml carbondisulfid; og 2,3 ml terpentinolie.
-Det er også opløseligt i flygtige og faste olier.
-Det er let opløseligt i petroleumsether.
-Dens opløselighed i hexan er 0,9 g / L, i methanol 71,5 g / L og i toluen 10,6 g / L.
Massefylde
1.316 g / ml ved 82,4 ºF og 1,2659 g / ml ved 15 ºC.
Dampmassefylde
4.21 (i forhold til luft taget som reference = 1)
Damptryk
1 mmHg ved 205ºF og 7,0 x 10-4 mmHg ved 25 ºC.
Stabilitet
En opløsning med en koncentration på 0,1% i vand er stabil i mindst 8 uger.
Nedbrydning
Nedbrydes ved opvarmning, udsender skarp og irriterende røg.
Viskositet
1,26 cPoise ved 130 ºC.
Forbrændingsvarme
3227 KJ / mol.
Fordampningsvarme
534 KJ / mol ved 249 ºC.
pH
Cirka 4 i vand.
Overfladespænding
31 N / m ved 130 ºC.
pKa
4,19 ved 25 ºC.
Brydningsindeks
1,504 - 1,5397 (ηD) ved 20 ºC.
Reaktioner
-I kontakt med baser (NaOH, KOH osv.) Danner den benzoatsalte. For eksempel, hvis det reagerer med NaOH, danner det natriumbenzoat, C6H5COONa.
-Reagerer med alkoholer for at danne estere. For eksempel giver dets reaktion med ethylalkohol ethylesteren. Nogle estere af benzoesyre fungerer som blødgørere.
-Reagerer med phosphorpentachlorid, PCl5, til dannelse af benzoylchlorid, et syrehalogenid. Benzoylchlorid kan reagere med ammonium (NH3eller en amin, såsom methylamin (CH3NHto) til dannelse af benzamid.
-Omsætningen af benzoesyre med svovlsyre frembringer sulfoneringen af den aromatiske ring. Den funktionelle gruppe -SO3H erstatter et hydrogenatom i ringens metaposition.
-Det kan reagere med salpetersyre ved anvendelse af svovlsyre som katalysator, der danner meta-nitrobenzoesyre.
-I nærvær af en katalysator, såsom jernchlorid, FeCl3, benzoesyre reagerer med halogener; reagerer for eksempel med chlor til dannelse af meta-chlorbenzoesyre.
Produktion
Nogle produktionsmetoder for denne forbindelse er anført nedenfor:
-Mest benzoesyre produceres industrielt ved at oxidere toluen med ilt i luften. Processen katalyseres af cobaltnaphthenat ved en temperatur på 140-160 ºC og ved et tryk på 0,2 - 0,3 MPa.
-Toluen kan derimod chloreres til dannelse af benzotrichlorid, som efterfølgende hydrolyseres til benzoesyre..
-Hydrolysen af benzonitril og benzamid i et surt eller alkalisk medium kan give anledning til benzoesyre og dens konjugatbaser..
-Benzylalkohol i en oxidation medieret af kaliumpermanganat i et vandigt medium producerer benzoesyre. Reaktionen sker ved opvarmning eller tilbagesvalingsdestillation. Når processen er afsluttet, filtreres blandingen for at eliminere mangandioxid, mens supernatanten afkøles for at opnå benzoesyre..
-Benzotrichloridforbindelsen omsættes med calciumhydroxid under anvendelse af jern- eller jernsalte som katalysatorer, idet der oprindeligt dannes calciumbenzoat, Ca6H5COO)to. Derefter omdannes dette salt ved omsætning med saltsyre til benzoesyre.
Ansøgninger
Industriel
-Det anvendes til fremstilling af phenol ved oxidativ decarboxylering af benzoesyre ved temperaturer på 300-400 ° C. Til hvilket formål? Fordi phenol kan bruges i syntesen af nylon.
-Ud fra det dannes glycolbenzoat, en kemisk forløber for diethylenglycolester og triethylenglycolester, stoffer der anvendes som blødgørere. Måske er den vigtigste anvendelse til blødgørere klæbemiddelformuleringer. Nogle estere med lang kæde bruges til at blødgøre plast som PVC.
-Det bruges som en gummipolymerisationsaktivator. Derudover er det et mellemprodukt til fremstilling af alkydharpikser såvel som tilsætningsstoffer til anvendelser til genvinding af råolie..
-Derudover anvendes det til produktion af harpikser, farvestoffer, fibre, pesticider og som et modificerende middel til polyamidharpiks til fremstilling af polyester. Det bruges til at opretholde aromaen af tobak.
-Det er en forløber for benzoylchlorid, som er et udgangsmateriale til syntese af forbindelser såsom benzylbenzoat, der anvendes til fremstilling af kunstige smagsstoffer og insektafvisende midler..
Medicinsk
-Det er en komponent i Whitfield salve, der bruges til at behandle svampe hudlidelser såsom ringorm og atletfod. Whitfields salve består af 6% benzoesyre og 3% salicylsyre..
-Det er en ingrediens i benzointinktur, der er blevet brugt som et topisk antiseptisk og inhalant decongestant. Benzoesyre blev brugt som en slimløsende, smertestillende og antiseptisk indtil begyndelsen af det 20. århundrede.
-Benzoesyre er blevet anvendt i eksperimentel terapi af patienter med resterende kvælstofakkumuleringssygdomme.
Madopbevaring
Benzoesyre og salte deraf anvendes til konservering af mad. Forbindelsen er i stand til at hæmme væksten af skimmelsvamp, gær og bakterier gennem en pH-afhængig mekanisme..
De virker på disse organismer, når deres intracellulære pH-værdi falder til en pH-værdi lavere end 5, hvilket næsten helt hæmmer den anaerobe gæring af glucose til produktion af benzoesyre. Denne antimikrobielle virkning kræver en pH mellem 2,5 og 4 for en mere effektiv handling..
-Bruges til konservering af fødevarer såsom frugtsaft, kulsyreholdige drikkevarer, sodavand med fosforsyre, syltede agurker og andre syrnet mad.
Ulempe
Det kan reagere med ascorbinsyre (vitamin C) til stede i nogle drikkevarer og producere benzen, en kræftfremkaldende forbindelse. På grund af dette leder vi efter andre forbindelser med evnen til at bevare mad, der ikke har benzoesyreproblemer..
Andre
-Det bruges i aktiv emballage og er til stede i ionomerfilm. Benzoinsyre frigøres fra dem, der er i stand til at hæmme væksten af arter af Penicillium- og Aspergillus-slægterne i mikrobielle medier..
-Det bruges som et konserveringsmiddel til aromaen af frugtsaft og parfume. Det bruges også med denne applikation i tobak.
-Benzoesyre bruges som et selektivt herbicid til at kontrollere bredbladet ukrudt og græs i sojabønner, agurker, meloner, jordnødder og træagtige prydplanter..
Toksicitet
-I kontakt med huden og øjnene kan det forårsage rødme. Indånding kan forårsage irritation af luftvejene og hoste. Indtagelse af store mængder benzoesyre kan forårsage gastrointestinale lidelser, som kan føre til lever- og nyreskader.
-Benzoesyre og benzoater kan frigive histamin, som kan forårsage allergiske reaktioner og irritation af øjne, hud og slimhinder..
-Det har ingen kumulativ, mutagen eller kræftfremkaldende virkning, da det absorberes hurtigt i tarmen og elimineres i urinen uden at akkumuleres i kroppen..
-Den maksimale dosis, der er tilladt i henhold til WHO, er 5 mg / kg legemsvægt / dag, ca. 300 mg / dag. Akut toksicitetsdosis hos mennesker: 500 mg / kg.
Referencer
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Kemikaliebog. (2017). Benzoesyre. Gendannet fra: chemicalbook.com
- PubChem. (2018). Benzoesyre. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Benzoesyre. Gendannet fra: en.wikipedia.org
- Dadachanji, Dinshaw. (18. maj 2018). Kemiske egenskaber af benzoesyre. Videnskabelig. Gendannet fra: sciencing.com
- Ministeriet for arbejde og sociale anliggender Spanien. (s.f.). Benzoesyre [PDF]. Internationale kemiske sikkerhedskort. Gendannet fra: insht.es


Endnu ingen kommentarer