
Hydroiodic acid (HI) struktur, egenskaber og anvendelser

Det hydroiodic syre Det er en vandig opløsning af hydrogeniodid, der er kendetegnet ved sin høje syreindhold. En definition tættere på den kemiske og IUPAC-terminologi er, at det er et hydracid, hvis kemiske formel er HI.
For at skelne det fra gasformige hydrogeniodidmolekyler betegnes HI (g) imidlertid HI (aq). Det er af denne grund, at det i kemiske ligninger er vigtigt at identificere den medium eller fysiske fase, hvor reaktanterne og produkterne findes. Alligevel er forveksling mellem hydrogeniodid og hydroiodsyre almindelig..
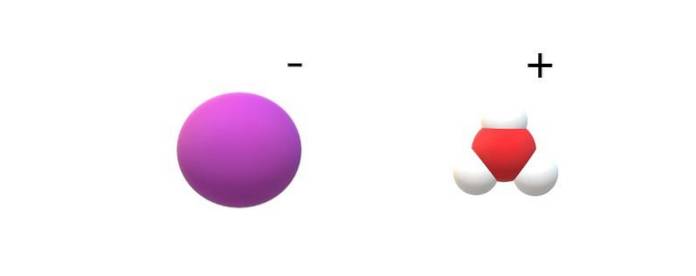
Hvis de molekyler, der er begået i deres identitet, observeres, vil der være mærkbare forskelle mellem HI (g) og HI (ac). I HI (g) er der en H-binding; mens de er i HI (ac), er de faktisk et ionpar I- og H3ELLER+ interagerer elektrostatisk (øverste billede).
På den anden side er HI (ac) en kilde til HI (g), da den første fremstilles ved opløsning af den anden i vand. På grund af dette, medmindre det er i en kemisk ligning, kan HI også bruges til at henvise til hydroiodsyre. HI er et stærkt reduktionsmiddel og en fremragende kilde til I-ioner.- i vandigt medium.
Artikelindeks
- 1 Struktur af hydroiodsyre
- 2 egenskaber
- 2.1 Fysisk beskrivelse
- 2.2 Molekylær masse
- 2.3 Lugt
- 2.4 Tæthed
- 2.5 Kogepunkt
- 2,6 pKa
- 2.7 Surhed
- 2.8 Reduktionsmiddel
- 3 Nomenklatur
- 4 anvendelser
- 4.1 Kilde til jod i organiske og uorganiske synteser
- 4.2 Reduktionsmiddel
- 4.3 Cativa-proces
- 4.4 Ulovlige synteser
- 5 Referencer
Struktur af hydroiodsyre
Hydroiodic syre, som netop forklaret, består af en opløsning af HI i vand. At være i vand adskiller HI-molekylerne sig fuldstændigt (stærk elektrolyt), der stammer fra I-ionerne- og H3ELLER+. Denne dissociation kan repræsenteres af følgende kemiske ligning:
HI (g) + HtoO (l) => I-(ac) + H3ELLER+(ac)
Hvad ville være ækvivalent, hvis det blev skrevet som:
HI (g) + HtoO (l) => HI (ac)
Imidlertid afslører HI (ac) slet ikke, hvad der er sket med de gasformige HI-molekyler; det indikerer kun, at de er i et vandigt medium.
Derfor består den sande struktur af HI (ac) af ionerne I- og H3ELLER+ omgivet af vandmolekyler, der hydrerer dem; jo mere koncentreret hydroiodsyre, jo lavere er antallet af ikke-fotoniserede vandmolekyler.
Kommercielt er HI-koncentrationen faktisk 48 til 57% i vand; mere koncentreret svarer til at have for rygende syre (og endnu farligere).
På billedet kan det ses, at anionen I- er repræsenteret af en lilla kugle, og H3ELLER+ med hvide kugler og en rød til iltatomet. Kationen H3ELLER+ har trigonal pyramidemolekylgeometri (set fra et højere plan i billedet).
Ejendomme
Fysisk beskrivelse
Farveløs væske men den kan udvise gule og brune toner, hvis den er i direkte kontakt med ilt. Dette er fordi ionerne jeg- ender med at oxidere til molekylært iod, Ito. Hvis der er meget jegto, det er mere end sandsynligt, at triiodidanionen dannes, I3-, der pletter opløsningen brun.
Molekylær masse
127,91 g / mol.
Lugt
Hektar.
Massefylde
Densiteten er 1,70 g / ml for 57% HI-opløsningen; da densiteterne varierer afhængigt af de forskellige koncentrationer af HI. Ved denne koncentration dannes en azeotrop (den destilleres som et enkelt stof og ikke som en blanding), hvis relative stabilitet det kan skyldes dets kommercialisering i forhold til andre opløsninger..
Kogepunkt
57% HI azeotrop koger ved 127 ° C ved et tryk på 1,03 bar (GO TO ATM).
pKa
-1,78.
Surhed
Det er en ekstremt stærk syre, så meget, at den er ætsende for alle metaller og stoffer; selv for gummi.
Dette skyldes, at H-bindingen er meget svag, og den bryder let under ionisering i vand. Desuden er hydrogenbindinger I- - HOHto+ er svage, så der er intet at blande sig med H3ELLER+ reagere med andre forbindelser; det vil sige H3ELLER+ har været "fri", ligesom jeg- det tiltrækker ikke med for meget kraft til hans modarbejde.
Reduktionsmiddel
HI er et stærkt reduktionsmiddel, hvis hovedreaktionsprodukt er Ito.
Nomenklatur
Nomenklaturen for hydroiodsyre stammer fra det faktum, at jod "virker" med en enkelt oxidationstilstand: -1. Og det samme navn indikerer også, at det har vand inden for dets strukturformel [I-] [H3ELLER+]. Dette er dets eneste navn, da det ikke er en ren forbindelse, men en opløsning.
Ansøgninger
Kilde til jod i organiske og uorganiske synteser
HI er en fremragende kilde til ioner I- til uorganiske og organiske synteser og er også et stærkt reduktionsmiddel. F.eks. Anvendes dets 57% vandige opløsning til syntese af alkyliodider (såsom CH3CHtoI) fra primære alkoholer. Ligeledes kan en OH-gruppe erstattes af en I i en struktur.
Reduktionsmiddel
Hydroiodic syre er blevet brugt til at reducere for eksempel kulhydrater. Hvis glucose opløst i denne syre opvarmes, mister den alle sine OH-grupper og opnår carbonhydrid n-hexan som et produkt..
Ligeledes er det blevet brugt til at reducere de funktionelle grupper af grafenark på en sådan måde, at de kan funktionaliseres til elektroniske enheder..
Cativa-proces

Trin
Processen begynder (1) med organo-iridium-komplekset [Ir (CO)tojegto]-, firkantet plan geometri. Denne forbindelse "modtager" methyliodid, CH3I, produkt af forsuring af CH3OH med 57% HI. Der produceres også vand i denne reaktion, og takket være den opnås endelig eddikesyre, samtidig med at HI genvindes i det sidste trin..
I dette trin både gruppen -CH3 som -I de binder til iridiummetallcentret (2) og danner et oktaedrisk kompleks med en facet bestående af tre I-ligander. En af ioderne ender med at blive erstattet af et molekyle kulilte, CO; og nu (3) har det oktaedriske kompleks en facet sammensat af tre CO-ligander.
Derefter opstår en omlægning: -CH-gruppen3 den "løsnes" fra Ir og binder til tilstødende CO (4) til dannelse af en acetylgruppe, -COCH3. Denne gruppe frigøres fra iridiumkomplekset for at binde til iodidioner og give CH3COI, acetyliodid. Her udvindes iridiumkatalysatoren, klar til at deltage i en anden katalytisk cyklus.
Endelig CH3IOC gennemgår en udskiftning af I- pr. molekyle HtoO, hvis mekanisme ender med at frigive HI og eddikesyre.
Ulovlige synteser

Det kan ses, at en substitution af OH-gruppen med I forekommer først efterfulgt af en anden substitution med en H.
Referencer
- Wikipedia. (2019). Hydroiodic syre. Gendannet fra: en.wikipedia.org
- Andrews, Natalie. (24. april 2017). Anvendelsen af hydriodinsyre. Videnskabelig. Gendannet fra: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodinsyre. Gendannet fra: alfa.com
- National Center for Biotechnology Information. (2019). Hydriodinsyre. PubChem Database., CID = 24841. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Illustreret ordliste for organisk kemi: Hydroiodic acid. Gendannet fra: chem.ucla.edu
- Reusch William. (5. maj 2013). Kulhydrater. Gendannet fra: 2.chemistry.msu.edu
- I Kyu Moon, Junghyun Lee, Rodney S. Ruoff og Hyoyoung Lee. (2010). Reduceret grafenoxid ved kemisk grafitisering. DOI: 10.1038 / ncomms1067.



Endnu ingen kommentarer