
Hydrogencyanidmolekylær struktur, egenskaber, anvendelser
Det hydrocyansyre eller hydrogencyanid er en organisk forbindelse, hvis kemiske formel er HCN. Det er også kendt som methanonitril eller formonitril og indtil flere år siden som blussinsyre, selvom dette faktisk er en anden forbindelse.
Hydrocyansyre er en ekstremt giftig, farveløs gas, der opnås ved behandling af cyanider med syrer. Denne syre findes inde i frø af ferskner, også kendt mange steder som ferskner..

Ved en omgivelsestemperatur på mindre end 25 ºC er det en væske og over denne temperatur er det en gas. I begge tilfælde er det ekstremt giftigt for mennesker, dyr og endda de fleste mikroorganismer, der ikke er vant til det. Det er et godt opløsningsmiddel til ioner. Det er meget ustabilt, da det har tendens til let at polymerisere.
Det findes i planteriget inkorporeret i molekylerne i nogle glycosider, fordi når disse hydrolyseres af enzymer fra planten, opnås HCN, glucose og benzaldehyd..
Disse glykosider er inden for frøene til visse frugter såsom ferskner, abrikoser, kirsebær, blommer og i bitre mandler, så de bør aldrig indtages..
Det findes også i planteglykosider, såsom nogle typer sorghum. Også nogle bakterier producerer det under deres stofskifte. Det bruges hovedsageligt til produktion af polymerer og i nogle metallurgiske processer.
HCN er en dødelig gift ved indånding, indtagelse og kontakt. Det er til stede i cigaretrøg og i røg fra brande af plast og materialer, der indeholder kulstof og kvælstof. Det betragtes som et atmosfærisk forurenende stof, fordi det produceres under forbrænding af organisk materiale fra store områder på planeten.
Artikelindeks
- 1 Molekylær struktur og elektronisk konfiguration
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Flammepunkt
- 3.6 Selvantændelsestemperatur
- 3.7 Densitet
- 3.8 Opløselighed
- 3.9 Dissociationskonstant
- 3.10 Nogle kemiske egenskaber
- 3.11 Korrosivitet
- 4 Placering i naturen
- 5 anvendelser
- 5.1 Ved fremstilling af andre kemiske forbindelser og polymerer
- 5.2 Forskellige anvendelser
- 5.3 I landbruget
- 6 risici
- 6.1 Mekanisme for dødelig handling i kroppen
- 6.2 Risiko for cigaretrøg
- 6.3 Risici ved opvarmning af HCN
- 6.4 Tilstedeværelse af HCN i brandrøg
- 6.5 Luftforurenende stof
- 7 Referencer
Molekylær struktur og elektronisk konfiguration
Hydrocyansyre eller hydrogencyanid er en kovalent, molekylær forbindelse med et hydrogen-, et carbon- og et nitrogenatom..
Kulstofatomet og nitrogenatomet deler 3 par elektroner, så de danner en tredobbelt binding. Brint er bundet til kulstof, som med denne binding præsenterer sin valens på fire og dets komplette elektronoktet.
Kvælstof har en valens på fem, og for at fuldføre sin oktet har den et par uparrede eller ensomme elektroner placeret sideværts.
HCN er derfor et fuldstændigt lineært molekyle med et uparret par elektroner placeret lateralt i nitrogenet..
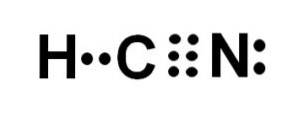
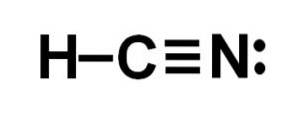
Nomenklatur
- Hydrocyansyre
- Hydrogencyanid
- Methanonitril
- Formonitril
- Hydrocyansyre
Ejendomme
Fysisk tilstand
Hvis den er vandfri og stabiliseret under 25,6 ºC, er den en farveløs eller lyseblå væske, der er meget ustabil og giftig. Hvis det er over denne temperatur, er det en ekstremt giftig farveløs gas.
Molekylær vægt
27,03 g / mol
Smeltepunkt
-13,28 ºC
Kogepunkt
25,63 ºC (bemærk at det koger lige over stuetemperatur).
Flashpoint
-18 ºC (lukket kopmetode)
Selvantændelsestemperatur
538 ºC
Massefylde
0,6875 g / cm3 ved 20 ºC
Opløselighed
Fuldt blandbar med vand, ethylalkohol og ethylether.
Dissociation konstant
K = 2,1 x 10-9
pKtil = 9,2 (det er en meget svag syre)
Nogle kemiske egenskaber
HCN har en meget høj dielektrisk konstant (107 til 25 ºC). Dette skyldes, at dets molekyler er meget polære og forbinder gennem hydrogenbindinger, som i tilfældet med vand HtoELLER.
På grund af sin høje dielektriske konstant viser HCN sig at være et godt ioniserende opløsningsmiddel..
Flydende vandfri HCN er meget ustabil, det har tendens til at polymerisere voldsomt. For at undgå dette tilsættes stabilisatorer, såsom en lille procentdel af HtoSW4.
I vandig opløsning og i nærværelse af ammoniak og højt tryk danner det adenin, en forbindelse, der er en del af DNA og RNA, det vil sige et biologisk vigtigt molekyle.
Det er en meget svag syre, da ioniseringskonstanten er meget lille, så den ioniseres kun delvist i vand, hvilket giver cyanidanionen CN-. Danner salte med baser, men ikke med carbonater.
Dens vandige opløsninger, der ikke er beskyttet mod lys, nedbrydes langsomt og genererer ammoniumformiat HCOONH4.
I opløsning har den en svag mandellugt.
Ætsende
Da det er en svag syre, er den generelt ikke ætsende.
Vandige opløsninger af HCN, der indeholder svovlsyre som stabilisator, angriber dog stærkt stål ved temperaturer over 40 ° C og rustfrit stål ved temperaturer over 80 ° C..
Desuden kan fortyndede vandige opløsninger af HCN forårsage stress på kulstofstål selv ved stuetemperatur..
Det kan også angribe nogle typer gummi, plast og belægning.
Placering i naturen
Det findes relativt rigeligt i planteriget som en del af glykosider.
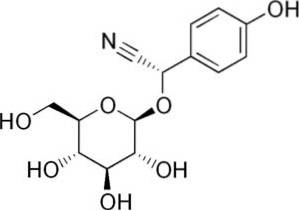
For eksempel er det genereret fra amygdalin C6H5-CH (-CN) -O-glukose-O-glukose, en forbindelse til stede i bitre mandler. Amygdalin er et cyanogent beta-glucosid, da det, når det hydrolyseres, danner to glukosemolekyler, et af benzaldehyd og et af HCN. Det enzym, der frigiver dem, er beta-glucoxidase.
Amygdalin findes i frøene af ferskner, abrikoser, bitre mandler, kirsebær og blommer..
Nogle typer sorghumplanter indeholder det cyanogene glycosid durrin (dvs. p-hydroxy- (S) -mandelonitril-beta-D-glucosid). Denne forbindelse kan nedbrydes ved en totrins enzymatisk hydrolyse.
For det første hydrolyserer enzymet durrinase, der er endogent i sorghumplanter, det til glucose og p-hydroxy- (S) -mandelonitril. Sidstnævnte omdannes derefter hurtigt til frit HCN og p-hydroxybenzaldehyd.

HCN er ansvarlig for sorghumplanternes resistens over for skadedyr og patogener.
Dette forklares med det faktum, at durrin og enzymet durrinase har forskellige placeringer i disse planter, og de kommer kun i kontakt, når vævene bliver skadet eller ødelagt, hvilket frigiver HCN og beskytter planten mod infektioner, der kan trænge igennem den skadede del..
Derudover er nogle humane patogene bakterier såsom Pseudomonas aeruginosa Y P. gingivalis de producerer det under deres metaboliske aktivitet.
Ansøgninger
Ved fremstilling af andre kemiske forbindelser og polymerer
Den anvendelse, der involverer det meste af HCN produceret på industrielt niveau, er fremstillingen af mellemprodukter til organisk syntese..
Det bruges i syntesen af adiponitril NC- (CHto)4-CN, som bruges til at fremstille nylon eller nylon, et polyamid. Det bruges også til at fremstille acrylonitril eller cyanoethylen CHto= CH-CN, brugt til fremstilling af akrylfibre og plast.
Dens afledte natriumcyanid NaCN anvendes til genvinding af guld i minedrift af dette metal.
Et andet af dets derivater, cyanogenchlorid ClCN, anvendes til pesticidformler.
HCN anvendes til fremstilling af chelateringsmidler, såsom EDTA (ethylendiamin-tetraacetat).
Det bruges til fremstilling af ferrocyanider og nogle farmaceutiske produkter.
Forskellige anvendelser
HCN-gas er blevet brugt som insekticid, fungicid og desinfektionsmiddel til gasning af skibe og bygninger. Også for at ryge møbler for at gendanne dem.
HCN er blevet brugt til metalpolering, galvanisering af metal, fotografiske processer og metallurgiske processer..
På grund af dets høje toksicitet blev det udpeget som et kemisk krigsførelsesmiddel..
I landbruget
Det er blevet brugt som et herbicid og pesticid i frugtplantager. Det blev brugt til at kontrollere skalaer og andre patogener på citrus træer, men nogle af disse skadedyr er blevet resistente over for HCN.
Det er også blevet brugt til at desinficere kornsiloer. HCN-gas tilberedt på stedet er blevet brugt til røgning af hvedekorn for at bevare dem mod skadedyr såsom insekter, svampe og gnavere. Til denne anvendelse er det vigtigt, at frøene, der skal ryges, tåler pesticidmidlet..
Test er udført ved sprøjtning af hvedefrø med HCN, og det har vist sig, at det ikke påvirker deres spiringspotentiale negativt, snarere synes det at favorisere det..
Imidlertid kan høje doser HCN reducere længden af de små blade, der spirer fra frøet, markant..
På den anden side, på grund af det faktum, at det er et kraftigt nematicid, og at nogle sorghumplanter har det i deres væv, undersøges potentialet for sorghumplanter til at blive brugt som biocid grøn gødning..
Dens anvendelse vil tjene til at forbedre jorden, undertrykke ukrudt og kontrollere sygdomme og skader forårsaget af fytoparasitiske nematoder..
Risici
For mennesker er HCN en dødelig gift på alle måder: indånding, indtagelse og kontakt..

Indånding kan være dødelig. Det anslås, at ca. 60-70% af befolkningen kan opdage den bitre mandellugt af HCN, når den er i luft i en koncentration på 1-5 ppm.
Men der er 20% af befolkningen, der ikke kan opdage det selv ved dødelige koncentrationer, fordi de genetisk ikke er i stand til at gøre det.
Indtaget er det en akut og øjeblikkelig virkende gift..
Hvis deres opløsninger kommer i kontakt med huden, kan det associerede cyanid være dødelig.
HCN er til stede i cigaretrøg, og som dannes, når plast, der indeholder kvælstof, forbrændes.
Dødelig virkningsmekanisme i kroppen
Det er en kemisk kvælningsmiddel og er hurtigt giftig og fører ofte til døden. Når det kommer ind i kroppen, binder det sig til metalloenzymer (enzymer, der indeholder en metalion) og inaktiverer dem. Det er et giftigt middel til forskellige organer i menneskekroppen
Dens vigtigste toksiske virkning består i inhibering af cellulær respiration, da det deaktiverer et enzym, der påvirker fosforylering i mitokondrier, som er organeller, der blandt andet griber ind i cellernes åndedrætsfunktion..
Risiko for cigaretrøg
HCN er til stede i cigaretrøg.
Selvom mange mennesker kender HCNs forgiftningseffekt, er det få mennesker, der er klar over, at de udsættes for dets skadelige virkning gennem cigaretrøg..
HCN er en af årsagerne til inhiberingen af flere cellulære respiratoriske enzymer. Mængden af HCN til stede i cigaretrøg har en særlig skadelig virkning på nervesystemet..
HCN-niveauer i cigaretrøg er blevet rapporteret mellem 10 og 400 μg pr. Cigaret for direkte inhaleret røg og 0,006 til 0,27 μg / cigaret til sekundær inhalation (brugt røg). HCN producerer toksiske effekter fra 40 μM og fremefter.

Ved indånding kommer den hurtigt ind i blodbanen, hvor den frigives i plasma eller binder til hæmoglobin. En lille del omdannes til thiocyanat og udskilles i urinen.
Risici ved HCN opvarmning
Langvarig udsættelse for varme af flydende HCN i lukkede beholdere kan forårsage uventet voldsomt brud på beholderne. Kan polymerisere eksplosivt ved 50-60 ° C i nærvær af spor af alkali og i fravær af inhibitorer.
Tilstedeværelse af HCN i røg fra brande
HCN frigives under forbrændingen af nitrogenholdige polymerer, såsom uld, silke, polyacrylonitriler og nylon, blandt andre. Disse materialer er til stede i vores hjem og de fleste steder af menneskelig aktivitet.
Af denne grund kan HCN under brande potentielt være dødsårsagen ved indånding..
Atmosfærens forurenende stof
HCN er et forurenende stof i troposfæren. Den er modstandsdygtig over for fotolyse og under de omgivende forhold i atmosfæren gennemgår den ikke hydrolyse.
Fotokemisk produceret hydroxyl OH • radikaler kan reagere med HCN, men reaktionen er meget langsom, så halveringstiden for HCN i atmosfæren er 2 år.
Når biomasse, især tørv, forbrændes, frigives HCN i atmosfæren og også under industrielle aktiviteter. Forbrænding af tørv er imidlertid 5 til 10 gange mere forurenende end afbrænding af andre typer biomasse.
Nogle forskere har fundet ud af, at de høje temperaturer og tørke forårsaget af El Niño-fænomenet i visse områder på planeten forværrer sæsonbrande i områder med et højt indhold af nedbrudt plantemateriale..

Dette fører til intens biomassebrænding i tørre årstider..
Disse begivenheder er kilden til høje koncentrationer af HCN i troposfæren, som til sidst transporteres til den nedre stratosfære og forbliver i meget lang tid..
Referencer
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- OS. National Library of Medicine. (2019). Hydrogencyanid. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Hydrogencyanid - en opdatering. Erhvervsmedicin 2017; 67: 662-663. Gendannet fra ncbi.nlm.nih.gov.
- Van Nostrand's Scientific Encyclopedia. (2005). Hydrogencyanid. 9th Gendannet fra onlinelibrary.wiley.com.
- Ren, Y.-L. et al. (nitten seksoghalvfems). Virkning af hydrogencyanid og carbonylsulfid på spiring og hvede af hvede. Pesticid. Sci. 1996, 47, 1-5. Gendannet fra onlinelibrary.wiley.com.
- Fra Nicola, G.R. et al. (2011). En simpel analytisk metode til evaluering af indhold af dhurrin i cyanogene planter til deres anvendelse i foder og biofumigation. J. Agric. Food Chem.2011, 59, 8065-8069. Gendannet fra pubs.acs.org.
- Sheese, P.E. et al. (2017). En global forbedring af hydrogencyanid i den nedre stratosfære i hele 2016. Geophys. Res. Lett., 44, 5791-5797. Gendannet fra agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. og Drochioiu, G. (2013). Visualisering af rygefare: En simpel spektrofotometrisk bestemmelse af hydrogencyanid i cigaretrøg og filtre. J. Chem. Educ. 2013, 90, 1654-1657. Gendannet fra pubs.acs.org.
- Alarie, Y. et al. (1990). Hydrogencyanids rolle i menneskedødsfald i brand. I ild og polymerer. Kapitel 3. ACS Symposium Series. Gendannet fra pubs.acs.org.



Endnu ingen kommentarer