
Citronsyrestruktur, egenskaber, produktion og anvendelser
Det Citronsyre er en organisk forbindelse, der består af en svag syre, hvis kemiske formel er C6H8ELLER7. Som navnet antyder, er en af de vigtigste naturlige kilder citrusfrugter, og det stammer også fra det latinske ord 'citrus', som betyder bitter..
Ikke kun er det en svag syre, den er også polyprotisk; det vil sige, det kan frigive mere end en hydrogenion, H+. Det er netop en tricarboxylsyre, så den har tre -COOH-grupper, der donerer H-ioner+. Hver af dem har deres egen tendens til at frigøre sig i deres miljø..

Derfor er dens strukturformel bedre defineret som C3H5O (COOH)3. Dette er den kemiske årsag til dets bidrag til den karakteristiske smag af for eksempel appelsinsegmenter. Selvom det kommer fra frugterne, blev dets krystaller ikke isoleret før i 1784 fra en citronsaft i England.
Det udgør ca. 8 masseprocent af nogle citrusfrugter, såsom citroner og grapefrugter. Det kan også findes i peberfrugter, tomater, artiskokker og andre fødevarer..
Artikelindeks
- 1 Hvor findes citronsyre?
- 2 Struktur af citronsyre
- 2.1 Intermolekylære interaktioner
- 3 Fysiske og kemiske egenskaber
- 3.1 Molekylvægt
- 3.2 Fysisk udseende
- 3.3 Smag
- 3.4 Smeltepunkt
- 3.5 Kogepunkt
- 3.6 Tæthed
- 3.7 Opløselighed
- 3,8 pKa
- 3.9 Nedbrydning
- 3.10 Derivater
- 4 Produktion
- 4.1 Kemisk eller syntetisk syntese
- 4.2 Naturlig
- 4.3 Ved gæring
- 5 anvendelser
- 5.1 I fødevareindustrien
- 5.2 I medicinalindustrien
- 5.3 I den kosmetiske industri og generelt
- 6 Toksicitet
- 7 Referencer
Hvor findes citronsyre?
Det findes i lave proportioner i alle planter og dyr, og det er en metabolit af levende væsener. Det er en mellemforbindelse med aerob stofskifte til stede i tricarboxylsyrecyklus eller citronsyrecyklus. I biologi eller biokemi er denne cyklus også kendt som Krebs-cyklussen, en amfibolvej for metabolisme.
Udover at den findes naturligt i planter og dyr, opnås denne syre syntetisk i stor skala gennem fermentering..
Det er meget brugt i fødevareindustrien, i lægemidler og kemikalier, og det opfører sig som et naturligt konserveringsmiddel. Det og dets derivater fremstilles massivt på industrielt niveau for at smage faste og flydende fødevarer.
Finder anvendelse som tilsætningsstof i forskellige hudskønhedsprodukter; det bruges også som et chelaterende, forsurende og antioxidant middel. Imidlertid anbefales dets anvendelse i høje eller rene koncentrationer ikke; da det kan forårsage irritation, allergier og endda kræft.
Citronsyrestruktur
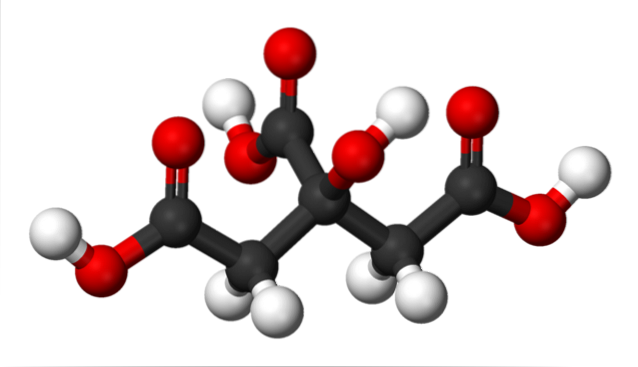
På det øverste billede er strukturen af citronsyre repræsenteret med en kugle- og søjlemodel. Hvis du ser nøje, kan du finde skelettet på kun tre carbonatomer: propan.
Kulstofatomet i centrum er bundet til en gruppe -OH, som i nærværelse af carboxylgrupper, -COOH, anvender terminologien 'hydroxy'. De tre -COOH-grupper er let genkendelige i venstre og højre ende og øverst i strukturen; Det er fra disse, hvor H frigives+.
På den anden side er -OH-gruppen også i stand til at miste en sur proton, så der vil i alt ikke være tre H+, men fire. Imidlertid kræver sidstnævnte en betydeligt stærk base, og følgelig er dens bidrag til den karakteristiske surhed af citronsyre meget mindre sammenlignet med -COOH-grupperne..
Af alt det ovenstående følger, at citronsyre også kan kaldes: 2-hydroxy-1,2,3-tricarboxylpropan.
Der er en -OH-gruppe i C-2, som støder op til -COOH-gruppen (se det øverste centrum af strukturen). På grund af dette falder citronsyre også under klassificeringen af alfa-hydroxy syrer; hvor alfa betyder 'tilstødende', dvs. der er kun et carbonatom, der adskiller -COOH og -OH.
Intermolekylære interaktioner
Som det kan ses, har citronsyrestrukturen en høj kapacitet til at donere og acceptere hydrogenbindinger. Dette gør det meget relateret til vand, og også grunden til, at det meget let danner et monohydrat, rhombohedriske krystaller..
Disse hydrogenbindinger er også ansvarlige for at opføre de farveløse monokliniske krystaller af citronsyre. Vandfri krystaller (uden vand) kan opnås efter dannelse i varmt vand efterfulgt af fuldstændig fordampning..
Fysiske og kemiske egenskaber
Molekylær vægt
210,14 g / mol.
Fysisk fremtoning
Farveløse og lugtfri syrekrystaller.
Smag
Sur og bitter.
Smeltepunkt
153 ° C.
Kogepunkt
175 ° C.
Massefylde
1,66 g / ml.
Opløselighed
Det er en meget opløselig forbindelse i vand. Det er også meget opløseligt i andre polære opløsningsmidler, såsom ethanol og ethylacetat. I apolære og aromatiske opløsningsmidler som benzen, toluen, chloroform og xylen er det uopløseligt.
pKa
-3.1
-4.7
-6.4
Dette er pKa-værdierne for hver af de tre -COOH-grupper. Bemærk, at den tredje pKa (6,4) næppe er sur, så den adskiller sig lidt.
Nedbrydning
Ved ekstreme temperaturer eller over 175 ° C nedbrydes frigivelsen af COto og vand. Derfor når væsken ikke en signifikant kogning, da den først nedbrydes..
Derivater
Når du mister H+, andre kationer indtager deres plads, men på en ionisk måde; det vil sige de negative ladninger fra -COO-grupperne- tiltrække andre arter af positive ladninger, såsom Na+. Jo mere deprotoneret citronsyre er, desto flere kationer har dens derivater kaldet citrater.
Et eksempel er natriumcitrat, som har en meget nyttig chelaterende virkning som et koaguleringsmiddel. Disse citrater kan derfor danne komplekser med metaller i opløsning..
På den anden side er H+ af -COOH-grupperne kan endda være substitueret med andre kovalent bundne arter, såsom R-sidekæder, hvilket giver anledning til citratestere: C3H5ELLER (COOR)3.
Mangfoldigheden er meget stor, da ikke alle H nødvendigvis skal erstattes af R, men også med kationer.
Produktion
Citronsyre kan produceres naturligt og kommercielt ved fermentering af kulhydrater. Dens produktion er også udført syntetisk gennem kemiske processer, der ikke holdes meget aktuelle i dag..
Flere bioteknologiske processer er blevet brugt til dets produktion, da denne forbindelse er i høj efterspørgsel over hele verden.
Kemisk eller syntetisk syntese
-En af disse kemiske synteseprocesser udføres under højtryksbetingelser fra calciumsalte af isocitrat. Saften ekstraheret fra citrusfrugter behandles med calciumhydroxid, og der opnås calciumcitrat..
Dette salt ekstraheres derefter og omsættes med en fortyndet svovlsyreopløsning, hvis funktion er at protonere citratet til dets oprindelige syreform..
-Citronsyre er også blevet syntetiseret fra glycerin ved at erstatte dens komponenter med en carboxylgruppe. Som netop nævnt er disse processer ikke optimale til produktion af citronsyre i stor skala..
naturlig
I kroppen forekommer citronsyre naturligt i aerob stofskifte: tricarboxylsyrecyklussen. Når acetylcoenzym A (acetyl-CoA) kommer ind i cyklussen, binder det sig med oxaloeddikesyre og danner citronsyre..
Og hvor kommer acetyl-CoA fra?
I reaktionerne ved katabolisme af fedtsyrer, kulhydrater, blandt andre substrater, i nærvær af Oto acetyl-CoA produceres. Dette er dannet som et produkt af beta-oxidation af fedtsyrer, ved transformation af pyruvat dannet i glykolyse.
Citronsyre dannet i Krebs-cyklussen eller citronsyrecyklussen oxideres til alfa-ketoglutarsyre. Denne proces repræsenterer en amfibolisk oxidationsreduktionsvej, hvorfra der genereres ækvivalenter, som derefter producerer energi eller ATP..
Imidlertid har den kommercielle produktion af citronsyre som mellemprodukt til aerob metabolisme heller ikke været rentabel eller tilfredsstillende. Kun under betingelser med organisk ubalance kan koncentrationen af denne metabolit øges, hvilket ikke er levedygtigt for mikroorganismer.
Ved gæring
Mikroorganismer, såsom svampe og bakterier, producerer citronsyre ved at fermentere sukker.
Produktionen af citronsyre fra mikrobiel gæring har givet bedre resultater end at opnå den ved kemisk syntese. Der er udviklet forskningslinjer relateret til denne massekommercielle produktionsmetode, som har givet store økonomiske fordele..
Dyrkningsteknikker på industrielt niveau har varieret over tid. Der er anvendt kulturer til overflade- og nedsænket gæring. Neddykkede kulturer er dem, hvor mikroorganismer producerer gæring fra substrater indeholdt i flydende medier.
Produktionsprocesserne for citronsyre ved nedsænket gæring, som finder sted under anaerobe forhold, har været optimale..
Nogle svampe kan lide Aspergillus niger, Saccahromicopsis sp, og bakterier som Bacillus licheniformis, har tilladt at opnå et højt udbytte med denne type gæring.
Svampe som Aspergillus niger eller candida sp, De producerer citronsyre som et resultat af gæring af melasse og stivelse. Rør, majs og sukkerroer anvendes blandt andet som gæringssubstrater..
Ansøgninger
Citronsyre anvendes i vid udstrækning i fødevareindustrien til fremstilling af farmaceutiske produkter. Det bruges også i utallige kemiske og bioteknologiske processer..
I fødevareindustrien
-Citronsyre bruges hovedsagelig i fødevareindustrien, da det giver dem en behagelig syrlig smag. Det er meget opløseligt i vand, så det tilsættes til drinks, slik, slik, gelé og frosne frugter. Det bruges også til fremstilling af vin, øl og andre drikkevarer..
-Ud over at tilføje en syrlig smag inaktiverer det sporstoffer, der beskytter ascorbinsyre eller vitamin C. Det fungerer også som et emulgator i is og oste. Bidrager til inaktivering af oxidative enzymer ved at sænke madens pH.
-Øger effektiviteten af konserveringsmidler tilsat mad. Ved at tilvejebringe en relativt lav pH-værdi nedsætter det sandsynligheden for, at mikroorganismer overlever i forarbejdede fødevarer og derved øger deres holdbarhed..
-I fedt og olier bruges citronsyre til at forstærke den synergistiske antioxidanteffekt (af alle fede komponenter), som denne type næringsstoffer kan have..
I medicinalindustrien
-Citronsyre bruges også i vid udstrækning som hjælpestof i den farmaceutiske industri for at forbedre smag og opløsning af medicin..
-I kombination med bicarbonat tilsættes citronsyre til produkter i pulverform og tabletter på en måde, der fungerer som et brusende middel.
-Saltene af citronsyre tillader dets anvendelse som et antikoagulant, da det har evnen til at chelatere calcium. Citronsyre administreres i mineraltilskud, såsom citratsalte.
-Ved at forsure mediet i absorptionsprocessen på tarmniveauet optimerer citronsyre optagelsen af vitaminer og nogle lægemidler. Dens vandfri form administreres som et supplement til andre lægemidler i opløsning af sten.
-Det bruges også som en forsurende, astringerende, som et middel, der letter opløsningen af de aktive ingredienser i forskellige farmaceutiske produkter..
I den kosmetiske industri og generelt
-Citronsyre bruges som chelateringsmiddel til metalioner i toiletartikler og kosmetik..
-Det bruges til rengøring og polering af metaller generelt og fjernelse af det oxid, der dækker dem.
-Ved lave koncentrationer fungerer det som tilsætningsstof i økologiske rengøringsmidler, der er godartede for miljøet og naturen..
-Det har en lang række anvendelser: det bruges i fotografiske reagenser, tekstiler, i lædergarvning.
-Føjes til trykfarver.
Toksicitet
Rapporter om dets toksicitet er forbundet med en høj koncentration af citronsyre, eksponeringstid, urenheder, blandt andre faktorer..
Citronsyreopløsninger, der er fortyndet, udgør ingen risiko eller sundhedsfare. Ren eller koncentreret citronsyre udgør dog en sikkerhedsrisiko og bør derfor ikke indtages..
Ren eller koncentreret, er ætsende og irriterende ved kontakt med hud og slimhinder i øjne, næse og hals. Kan forårsage allergiske hudreaktioner og akut toksicitet ved indtagelse..
Indånding af rent citronsyrestøv kan også påvirke slimhinden i luftvejene. Indånding kan forårsage åndenød, allergi, sensibilisering af luftvejsslimhinden og kan endda udløse astma.
Reproduktionstoksiske virkninger er rapporteret. Citronsyre kan forårsage genetiske defekter og forårsage mutation i kimceller.
Og endelig betragtes det som farligt eller giftigt for vandmiljøet, og generelt er koncentreret citronsyre ætsende for metaller..
Referencer
- BellChem (21. april 2015). Anvendelsen af citronsyre i fødevareindustrien. Gendannet fra: bellchem.com
- Vandenberghe, Luciana P. S, Soccol, Carlos R, Pandey, Ashok og Lebeault, Jean-Michel. (1999). Mikrobiel produktion af citronsyre. Brasilianske arkiver for biologi og teknologi, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Citronsyre. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Citronsyre. Gendannet fra: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. og Stanley, G. (2008). Kemi. (8ava. ed). CENGAGE Læring: Mexico.
- Berovic, M. og Legisa, M. (2007). Produktion af citronsyre. Årlig gennemgang af bioteknologi. Gendannet fra: researchgate.net

Endnu ingen kommentarer