
Kemiske kinetiske faktorer, reaktionsrækkefølge og anvendelser
Det kemisk kinetik Det er undersøgelsen af hastighederne for en reaktion. Nedled eksperimentelle eller teoretiske data om den molekylære mekanisme gennem love udtrykt ved matematiske ligninger. Mekanismer består af en række trin, hvoraf nogle er hurtige og andre er langsomme..
Den langsomste af disse kaldes det hastighedsbestemmende trin. Derfor er det meget vigtigt i kinetiske termer at kende de mellemliggende arter og driftsmekanismen i dette trin. En visualisering af ovenstående er at antage, at reagenserne er lukket i en flaske, og at produkterne, når de reagerer, flygter udad.

Endelig kommer produkterne frit ud af flaskens mund uden yderligere kinetiske hindringer. Fra dette perspektiv er der flasker i mange størrelser og designs. Imidlertid har de alle et fælles element: en smal hals, en indikator for det afgørende trin i reaktionen..
Artikelindeks
- 1 Hvad studerer kemisk kinetik?
- 2 Reaktionshastighed
- 2.1 Definition
- 2.2 Generel ligning
- 2.3 Desserteksempel
- 2.4 Sådan bestemmes det
- 3 faktorer, der påvirker reaktionshastighed
- 3.1 Kemiske arts art
- 3.2 Koncentration af reagenser
- 3.3 Temperatur
- 4 Reaktionsrækkefølge i kemisk kinetik
- 4.1 Nulbestillingsreaktioner
- 4.2 Førsteordens reaktion
- 4.3 Andenordens reaktion
- 4.4 Reaktionsrækkefølge versus molekylæritet
- 5 applikationer
- 6 Referencer
Hvad studerer kemisk kinetik?
Eksperimentelt studerer denne gren af kemien de koncentrationsvariationer, der er involveret i en kemisk reaktion, fra måling af en bestemt egenskab.
Kemisk kinetik er den gren af kemien, der har ansvaret for at studere al den information, der kan udledes af reaktionshastigheden. Dets navn inviterer dig til at forestille dig et lommeur, der markerer tidspunktet for en proces, uanset hvor det sker: i en reaktor, i en sky, i en flod, i menneskekroppen osv..
Alle kemiske reaktioner og derfor al transformation har termodynamiske, ligevægt og kinetiske aspekter. Termodynamik angiver, om en reaktion er spontan eller ej; balancen dens kvantificeringsgrad og kinetik de betingelser, der favoriserer dens hastighed og samt data om dens mekanisme.
Mange af de væsentlige aspekter af kemisk kinetik kan observeres i dagligdagen: i køleskabet, der fryser mad for at reducere dets nedbrydning ved at fryse det vand, der er en del af det. Også i modningen af vinene, hvis aldring giver det sine behagelige smag.
Imidlertid er "molekylernes tid" meget forskellig i sine små skalaer og varierer enormt efter mange faktorer (antal og typer af bindinger, størrelser, tilstandstilstande osv.).
Fordi tid er liv, og det er også penge, er det yderst vigtigt at vide, hvilke variabler der tillader en kemisk reaktion at gå så hurtigt som muligt. Nogle gange ønskes det modsatte: at reaktionen sker meget langsomt, især hvis den er eksoterm og der er risiko for eksplosion.
Hvad er disse variabler? Nogle er fysiske, som ved hvilket tryk eller temperatur en reaktor eller et system skal have; og andre er kemiske, såsom typen af opløsningsmiddel, pH, saltholdighed, molekylær struktur osv..
Før vi finder disse variabler, skal vi dog først undersøge kinetikken for den nuværende reaktion.
Hvordan? Gennem variationen af koncentration, som kan følges, hvis en bestemt egenskab, der er proportional med den første, kvantificeres. Gennem historien er metoder blevet mere sofistikerede, hvilket muliggør mere nøjagtige og præcise målinger og med stadig kortere intervaller..
Reaktionshastighed
For at bestemme hastigheden af en kemisk reaktion er det nødvendigt at vide, hvordan koncentrationen varierer over tid for nogen af de involverede arter. Denne hastighed afhænger i høj grad af mange faktorer, men det vigtigste er, at den kan måles for de reaktioner, der finder sted "langsomt".
Her er ordet "langsomt" relativt og defineres for alt, hvad der kan måles med de tilgængelige instrumentale teknikker. Hvis f.eks. Reaktionen er meget hurtigere end udstyrets målekapacitet, vil den ikke være kvantitativ, heller ikke kan dens kinetik undersøges..
Derefter bestemmes reaktionshastigheden ved tærsklen for enhver proces, før den når ligevægt. Hvorfor? Fordi i ligevægt er hastigheden af den fremadgående reaktion (produktdannelse) og den for den omvendte reaktion (reaktantdannelsen) den samme.
Ved at kontrollere de variabler, der virker på systemet og følgelig dets kinetik eller reaktionshastigheden, kan de ideelle betingelser vælges til at generere en bestemt mængde produkt på den mest ønskede og sikre tid..
På den anden side afslører denne viden den molekylære mekanisme, som er værdifuld, når man øger udbyttet af en reaktion..
Definition
Hastighed er ændringen af en størrelse som en funktion af tiden. For disse undersøgelser ligger interessen i at bestemme variationen i koncentrationen, når timer og minutter går; nano, pico eller endda femtosekunder (10-femtens).
Du kan have mange enheder, men den enkleste og nemmeste af alle er M s-1, eller hvad der er lig med mol / L · s. Uanset dens enheder skal det altid have en positiv værdi, da det er en fysisk størrelse (såsom dimensioner eller masse).
Imidlertid har hastigheden af forsvinden for en reaktant ifølge konvention et negativt tegn, og udseendet for et produkt har et positivt tegn..
Men hvis reaktanterne og produkterne har deres egne hastigheder, hvordan skal man så bestemme den samlede reaktionshastighed? Svaret er i de støkiometriske koefficienter.
Generel ligning
Den følgende kemiske ligning udtrykker reaktionen mellem A og B til dannelse af C og D:
tilTIL + bB => cC + dD
Molære koncentrationer udtrykkes normalt i firkantede parenteser, så fx er koncentrationen af art A skrevet som [A]. Således er reaktionshastigheden for hver af de involverede kemiske arter:
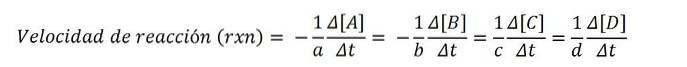
Ifølge den matematiske ligning er der fire ruter til at nå reaktionshastigheden: variationen i koncentration af en hvilken som helst af reaktanterne (A eller B) eller af produkterne (C eller D) måles..
Derefter divideres med en af disse værdier og dens korrekte støkiometriske koefficient med sidstnævnte og for at opnå reaktionshastigheden rxn.
Da reaktionshastigheden er en positiv størrelse, ganger det negative tegn de negative hastighedsværdier for reaktanterne; af denne grund koefficienterne til Y b gang med (-1).
For eksempel, hvis hastigheden af A forsvinden er - (5M / s), og dens støkiometriske koefficient til er 2, så hastigheden rxn er lig med 2,5M / s ((-1/2) x 5).
Desserteksempel

Hvis produktet var en dessert, ville ingredienserne analogt være reagenserne; og den kemiske ligning, opskriften:
7Cookies + 3 Brownies + 1 Ice Cream => 1 Dessert
Og hastighederne for hver af de søde ingredienser og til selve desserten er:
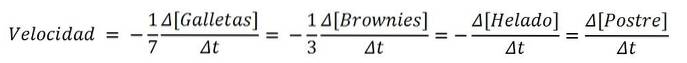
Således kan hastigheden, hvormed desserten fremstilles, bestemmes med variationen af enten kagerne, browniesne, isen eller selve sættet; derefter dividere det med dets støkiometriske koefficienter (7, 3, 1 og 1). En af ruterne kan dog være lettere end den anden..
Hvis du f.eks. Måler, hvordan [Dessert] stiger med forskellige tidsintervaller, kan disse målinger være vanskelige..
På den anden side kan det være mere bekvemt og praktisk at måle [Cookies] på grund af deres antal eller nogle af deres egenskaber, der gør deres koncentration lettere at bestemme end brownies eller is..
Hvordan man bestemmer det
I betragtning af den enkle reaktion A => B, hvis A for eksempel i vandig opløsning udviser en grøn farve, afhænger dette af dens koncentration. Når A bliver B, forsvinder den grønne farve således, og hvis denne forsvinden kvantificeres, kan der opnås en kurve på [A] vs t.
På den anden side, hvis B er en sur art, vil opløsningens pH falde til værdier under 7. Fra faldet i pH opnås således [B] og efterfølgende grafen [B] vs t. Derefter overlejrer begge grafer kan vi se noget i retning af følgende:

I grafen kan vi se, hvordan [A] falder med tiden, fordi det forbruges, og hvordan kurven [B] stiger med en positiv hældning, fordi det er produktet.
Det kan også ses, at [A] har en tendens til nul (hvis der ikke er nogen ligevægt), og at [B] når en maksimal værdi styret af støkiometri, og hvis reaktionen er færdig (alt A er forbrugt).
Reaktionshastigheden for både A og B er tangentlinien på en af disse kurver; med andre ord afledte.
Faktorer, der påvirker reaktionshastighed
Kemiske arts art
Hvis alle kemiske reaktioner var øjeblikkelige, ville deres kinetiske undersøgelser ikke eksistere. Mange har så høje hastigheder, at de ikke kan måles; de er ikke målbare.
Således er reaktionerne mellem ionerne normalt meget hurtige og komplette (med et udbytte omkring 100%). På den anden side kræver de, der involverer organiske forbindelser, noget tid. En reaktion af den første type er:
HtoSW4 + 2NaOH => NatoSW4 + 2HtoELLER
De stærke elektrostatiske interaktioner mellem ionerne favoriserer den hurtige dannelse af vand og natriumsulfat. I stedet er en reaktion af den anden type for eksempel forestring af eddikesyre:
CH3COOH + CH3CHtoOH => CH3COOCHtoCH3 + HtoELLER
Selvom der også dannes vand, er reaktionen ikke øjeblikkelig; selv under gunstige forhold tager det flere timer at gennemføre.
Imidlertid har andre variabler større indflydelse på reaktionshastigheden: koncentration af reaktanter, temperatur, tryk og tilstedeværelse af katalysatorer..
Reagenskoncentration
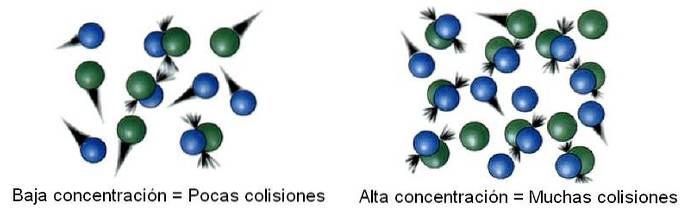
I kemisk kinetik kaldes det undersøgte rum, adskilt fra uendelig, et system. For eksempel kan en reaktor, et bægerglas, en kolbe, en sky, en stjerne osv. Betragtes som det undersøgte system..
Således inden i systemet er molekylerne ikke statiske, men snarere "rejser" til alle dets hjørner. I nogle af disse forskydninger kolliderer det med et andet molekyle for at hoppe tilbage eller producere produkter..
Derefter er antallet af kollisioner proportionalt med koncentrationen af reaktanterne. Billedet ovenfor illustrerer, hvordan systemet skifter fra lave til høje koncentrationer.
Jo flere kollisioner der er, jo hurtigere er reaktionshastigheden, da chancerne for at to molekyler reagerer øges..
Hvis reaktanterne er gasformige, håndteres trykvariablen og er relateret til gaskoncentrationen under antagelse af en hvilken som helst af de mange eksisterende ligninger (såsom den for den ideelle gas); eller også reduceres systemets volumen for at øge chancerne for, at de gasformige molekyler kolliderer.
Temperatur
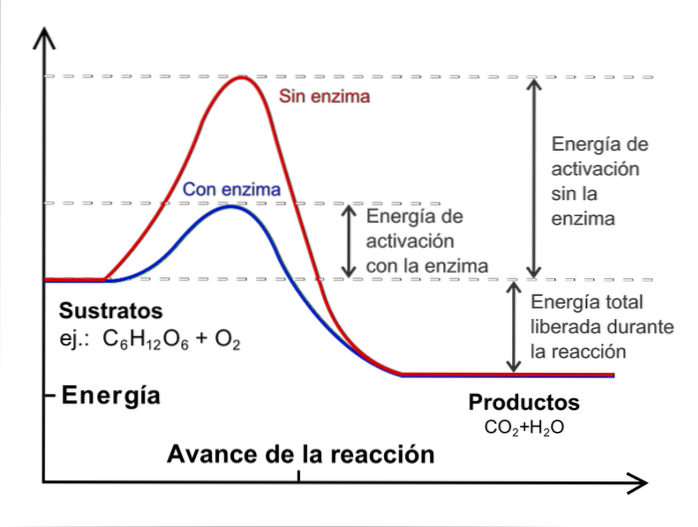
Selvom antallet af kollisioner stiger, har ikke alle molekyler den nødvendige energi til at overskride aktiveringsenergien i processen.
Det er her, temperatur spiller en vigtig rolle: den udfører funktionen af termisk acceleration af molekylerne, så de kolliderer med mere energi..
Således fordobles reaktionshastigheden generelt for hver 10 ° C stigning i systemtemperaturen. Dette er dog ikke altid tilfældet for alle reaktioner. Hvordan forudsiger man denne stigning? Arrhenius-ligningen svarer på spørgsmålet:
d (lnK) / dT = E / (RTto)
K er hastighedskonstanten ved temperaturen T, R er gaskonstanten og E er aktiveringsenergien. Denne energi er indikativ for den energibarriere, som reaktanterne skal skaleres for at reagere..
For at udføre en kinetisk undersøgelse er det nødvendigt at holde temperaturen konstant og uden katalysatorer. Hvad er katalysatorer? De er eksterne arter, der griber ind i reaktionen, men uden at blive forbrugt, og som mindsker aktiveringsenergien.
Billedet ovenfor illustrerer begrebet katalyse til reaktion af glucose med ilt. Den røde linje repræsenterer aktiveringsenergien uden enzymet (biologisk katalysator), mens den blå linje med det viser et fald i aktiveringsenergien.
Reaktionsrækkefølge i kemisk kinetik
I en kemisk ligning er de støkiometriske indeks, der er relateret til reaktionsmekanismen, ikke lig med indekserne i samme rækkefølge. Kemiske reaktioner har normalt første eller anden orden, sjældent tredje orden..
For hvad er dette? Fordi kollisionerne med tre energisk exciterede molekyler er usandsynlige, og endnu mere er firdobbelte eller femdobbelte kollisioner, hvor sandsynligheden er uendelig. Fraktionerede reaktionsordrer er også mulige. For eksempel:
NH4Cl <=>NH3 + HCI
Reaktionen er første orden i den ene forstand (fra venstre mod højre) og anden orden i den anden (fra højre til venstre), hvis den anses for at være en ligevægt. Mens følgende ligevægt er anden orden i begge retninger:
2HI <=> Hto + jegto
Er molekylæritet og reaktionsrækkefølge den samme? Nej. Molekularitet er antallet af molekyler, der reagerer for at give anledning til produkter, og den samlede reaktionsrækkefølge er den samme rækkefølge af de reaktanter, der er involveret i det bestemmende hastighedstrin..
2KMnO4 + 10KI + 8HtoSW4 => 2MnSO4 + 5Ito + 6KtoSW4 + 8HtoELLER
Denne reaktion, til trods for at have høje støkiometriske indekser (molekularitet), er faktisk en anden ordens reaktion. Med andre ord er det afgørende trin for hastigheden af anden orden.
Nul rækkefølge reaktioner
De forekommer i tilfælde af heterogene reaktioner. For eksempel: mellem en væske og et fast stof. Hastigheden er således uafhængig af koncentrationerne af reaktanterne.
Ligeledes, hvis en reaktant har en reaktionsrækkefølge på nul, betyder det, at den ikke deltager i det bestemmende trin for hastigheden, men i den hurtige.
Første ordens reaktion
A => B
En førsteordens reaktion er underlagt følgende satser:
V = k [A]
Hvis koncentrationen af A fordobles, fordobles reaktionshastigheden V. Derfor er hastigheden proportional med koncentrationen af reagenset i det bestemmende trin i reaktionen..
Anden ordens reaktion
2A => B
A + B => C
To arter er involveret i denne type reaktion, ligesom i de to kemiske ligninger, der netop er skrevet. Satsloven for reaktionerne er:
V = k [A]to
V = k [A] [B]
I det første er reaktionshastigheden proportional med kvadratet af koncentrationen af A, mens i den anden forekommer det samme som i reaktionerne i første orden: hastigheden er direkte proportional med koncentrationerne af både A og B.
Reaktionsrækkefølge versus molekylæritet
Ifølge det foregående eksempel kan de støkiometriske koefficienter måske eller ikke falde sammen med rækkefølgen af reaktionen.
Dette sker dog for elementære reaktioner, som bestemmer molekylmekanismen for ethvert trin i en reaktion. I disse reaktioner er koefficienterne lig med antallet af deltagende molekyler.
For eksempel reagerer et molekyle af A med et af B for at danne et molekyle af C. Her er molekylærheden 1 for reaktanterne, og i ekspressionen af hastighedsloven falder de sammen med reaktionsordren.
Heraf følger, at molekylæriteten altid skal være et heltal og sandsynligt mindre end fire.
Hvorfor? Fordi ved passage af en mekanisme er det meget usandsynligt, at fire molekyler deltager på samme tid; to af dem kunne reagere først, og derefter ville de resterende to reagere med dette produkt.
Matematisk er dette en af de største forskelle mellem reaktionsordrer og molekylæritet: en reaktionsordre kan tage brøkværdier (1/2, 5/2 osv.).
Dette skyldes, at førstnævnte kun afspejler, hvordan artens koncentration påvirker hastigheden, men ikke hvordan deres molekyler griber ind i processen..
Ansøgninger
- Det gør det muligt at bestemme den tid, et lægemiddel forbliver i kroppen, før det fuldstændige stofskifte. Takket være kinetiske undersøgelser kan enzymatisk katalyse ligeledes følges som grønne metoder sammenlignet med andre katalysatorer med negativ miljøpåvirkning; eller også til at blive brugt i utallige industrielle processer.
- I bilindustrien, specielt inden for motorer, hvor elektrokemiske reaktioner skal udføres hurtigt for at køretøjet kan starte. Også i dens udstødningsrør, som har katalysatorer til at omdanne de skadelige gasser CO, NO og NO.x i COto, HtoPÅto migto i den optimale tid.
2NaN3(s) = 2Na (s) + 3Nto(g)
-Det er reaktionen bag, hvorfor airbags, 'airbags', pustes op, når køretøjer kolliderer. Når dækkene smækker på bremserne, detonerer en detektor elektrisk natriumazidet, NaN3. Dette reagens "eksploderer" og frigiver Nto, der optager hurtigt hele volumen af posen.
Metallisk natrium reagerer derefter med andre komponenter for at neutralisere det, fordi det i dets rene tilstand er giftigt.
Referencer
- Walter J. Moore. (1963). Fysisk kemi. I Kemisk kinetik. Fjerde udgave, Longmans.
- Ira N. Levine. (2009). Principper for fysisk-kemi. Sjette udgave, s. 479-540. Mc Graw Hill.
- UAwiki. (23. december 2011). Molekylær-kollisioner-er. [Figur]. Hentet den 30. april 2018 fra: es.m.wikipedia.org
- Glasstone. (1970). Lærebog i fysisk kemi. I Kemisk kinetik. Anden version. D. Van Nostrand, Company, Inc.
- Anne Marie Helmenstine, Ph.D. (8. marts 2017). Definition af kemisk kinetik. Hentet den 30. april 2018 fra: thoughtco.com
- Khan Academy. (2018). Reaktionshastigheder og satslove. Hentet den 30. april 2018 fra: khanacademy.org
- Germán Fernández. (26. juli 2010). Kemisk kinetik. Hentet den 30. april 2018 fra: quimicafisica.com



Endnu ingen kommentarer