
Fosforsyre (H3PO3) egenskaber, risici og anvendelser

Det fosforsyre, også kaldet orthophosphorsyre, det er en kemisk forbindelse med formlen H3PO3. Det er en af de forskellige iltede syrer af fosfor, og dets struktur er vist i figur 1 (EMBL-EBI, 2015).
I betragtning af formlen for forbindelsen kan den omskrives som HPO (OH)to. Denne art findes i ligevægt med en mindre tautomer P (OH)3 (Figur 2).

IUPAC, 2005-anbefalingerne er, at sidstnævnte kaldes phosphorsyre, mens dihydroxyformen kaldes phosphonsyre. Kun reducerede fosforforbindelser staves med en "bjørn" -slutning..

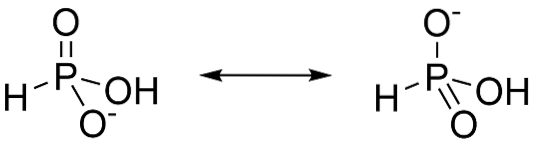
Fosforsyre er en diprotinsyre, det betyder, at den kun har evnen til at opgive to protoner. Dette skyldes, at majoritetens tautomer er H3PO3. Når denne form mister en proton, stabiliserer resonansen de dannede anioner, som vist i figur 3.
P (OH) 3-tautomeren (figur 4) har ikke fordelen ved resonansstabilisering. Dette gør fjernelsen af den tredje proton meget vanskeligere (hvorfor er phosphorsyre diprotisk og ikke triprotisk?, 2016).

Phosphorsyre (H3PO3) danner salte kaldet phosphitter, som bruges som reduktionsmidler (Britannica, 1998). Det fremstilles ved opløsning af tetrafosforhexoxid (P4ELLER6ifølge ligningen:
P4ELLER6 + 6 timertoO → 4 HPO (OH)to
Ren fosforsyre, H3PO3, bedst fremstillet ved hydrolyse af phosphortrichlorid, PCl3.
PCl3 + 3HtoO → HPO (OH)to + 3HCl
Den resulterende opløsning opvarmes for at drive HCI af, og det resterende vand inddampes, indtil det vises 3PO3 farveløs krystallinsk ved afkøling. Syren kan også opnås ved indvirkning af vand på PBr3 eller PI3 (Zumdahl, 2018).
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 2.1 Reaktivitet
- 2.2 Farer
- 2.3 Handling i tilfælde af skade
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber
Fosforsyre er hvide eller gule hygroskopiske tetraedriske krystaller med en hvidløgslignende aroma (National Center for Biotechnology Information, 2017).

H3PO3 den har en molekylvægt på 82,0 g / mol og en densitet på 1,651 g / ml. Forbindelsen har et smeltepunkt på 73 ° C og nedbrydes over 200 ° C. Fosforsyre er opløselig i vand og er i stand til at opløse 310 gram pr. 100 ml af dette opløsningsmiddel. Det er også opløseligt i ethanol.
Derudover er det en stærk syre med en pKa mellem 1,3 og 1,6 (Royal Society of Chemistry, 2015).
Opvarmning af fosforsyre til ca. 200 ° C får den til at stå uforholdsmæssigt i fosforsyre og phosphin (PH3). Fosfin, en gas, der normalt antænder spontant i luften.
4H3PO3 + varme → PH3 + 3H3PO4
Reaktivitet og farer
Reaktivitet
- Phosphorsyre er ikke en stabil forbindelse.
- Absorberer ilt fra luften for at danne fosforsyre.
- Danner gule aflejringer i vandig opløsning, der er spontant brandfarlige ved tørring.
- Reagerer eksotermt med kemiske baser (for eksempel aminer og uorganiske hydroxider) til dannelse af salte.
- Disse reaktioner kan generere farligt store mængder varme i små rum..
- Opløsning i vand eller fortynding af en koncentreret opløsning med yderligere vand kan generere betydelig varme.
- Reagerer i nærvær af fugt med aktive metaller, herunder strukturelle metaller som aluminium og jern, for at frigive brint, en brandfarlig gas.
- Det kan igangsætte polymeriseringen af visse alkener. Reagerer med cyanidforbindelser for at frigive gasformigt hydrogencyanid.
- Kan danne brandfarlige og / eller giftige gasser i kontakt med dithiocarbamater, isocyanater, mercaptaner, nitrider, nitriler, sulfider og stærke reduktionsmidler.
- Yderligere gasgenererende reaktioner forekommer med sulfitter, nitrit, thiosulfater (for at give H2S og SO3), dithionitter (for at give SO2) og carbonater (for at give CO2) (FOSFOR SYRE, 2016).
Farer
- Forbindelsen er ætsende for øjne og hud.
- Kontakt med øjnene kan resultere i hornhindeskader eller blindhed..
- Kontakt med huden kan forårsage betændelse og blærer.
- Indånding af støv vil medføre irritation i mave-tarm- eller luftvejene, der er karakteriseret ved forbrænding, nysen og hoste..
- Alvorlig overeksponering kan forårsage lungeskader, kvælning, bevidstløshedstab eller død (Sikkerhedsdatablad Fosforsyre, 2013).
Handling i tilfælde af skade
- Sikring af, at medicinsk personale er opmærksom på de involverede materialer og træffer forholdsregler for at beskytte sig selv.
- Offeret skal flyttes til et køligt sted, og akutmedicinsk tjeneste tilkaldes.
- Kunstig åndedræt skal gives, hvis offeret ikke trækker vejret.
- Mund-til-mund-metoden bør ikke anvendes, hvis offeret har indtaget eller inhaleret stoffet..
- Kunstig åndedræt udføres ved hjælp af en lommemaske udstyret med en envejsventil eller andet egnet respiratorisk medicinsk udstyr.
- Oxygen bør gives, hvis vejrtrækningen er vanskelig.
- Forurenet tøj og sko skal fjernes og isoleres.
- I tilfælde af kontakt med stoffet skylles straks huden eller øjnene med rindende vand i mindst 20 minutter..
- Undgå at sprede materialet på upåvirket hud for mindre hudkontakt..
- Hold offeret roligt og varmt.
- Virkningerne af eksponering (indånding, indtagelse eller hudkontakt) for stoffet kan være forsinket.
Ansøgninger
Den vigtigste anvendelse af fosforsyre er produktionen af fosfitter, der anvendes til vandbehandling. Phosphorsyre bruges også til at fremstille phosphitsalte, såsom kaliumphosphit..
Fosfitter har vist sig at være effektive til bekæmpelse af en række plantesygdomme.
Specielt er behandling med trunk eller bladinjektion indeholdende phosphorsyresalte indikeret som reaktion på infektioner af plantepatogener af typen phytoftera og pythium (de forårsager rodnedbrydning).
Phosphorsyre og phosphitter anvendes som reduktionsmidler i kemisk analyse. En bekvem og skalerbar ny syntese af phenyleddikesyrer gennem iodidkatalyseret reduktion af mandelsyrer er baseret på in situ-generering af hydroiodsyre fra katalytisk natriumiodid. Til dette anvendes fosforsyre som en støkiometrisk reducering (Jacqueline E. Milne, 2011).
Det bruges som en ingrediens til produktion af tilsætningsstoffer, der anvendes i polyvinylchloridindustrien (Phosphorsyre (CAS RN 10294-56-1), 2017). Også phosphorsyreestere anvendes i forskellige reaktioner i organisk syntese (Blazewska, 2009).
Referencer
- Blazewska, K. (2009). Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol 42. New York: Thieme.
- (1998, 20. juli). Fosforsyre (H3PO3). Gendannet fra Encyclopædia Britannica: britannica.com.
- EMBL-EBI. (2015, 20. juli). phosphonsyre. Gendannet fra ebi.ac.uk: ebi.ac.uk.
- Jacqueline E. Milne, T. S. (2011). Jodkatalyserede reduktioner: Udvikling af en syntese af fenyleddikesyrer. Org. Chem. 76, 9519-9524. organisk-kemi.org.
- Sikkerhedsdatablad Fosforsyre. (2013, 21. maj). Gendannet fra sciencelab: sciencelab.com.
- National Center for Biotechnology Information. (2017, 11. marts). PubChem Compound Database; CID = 107909. Hentet fra PubChem: ncbi.nlm.nih.gov.
- Fosforsyre (CAS RN 10294-56-1). (2017, 15. marts). Gendannet fra gov.uk/trade-tariff:gov.uk.
- FOSFOR SYRE. (2016). Gendannet fra cameochemicals: cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). FOSFOR SYRE. Gendannet fra chemspider: chemspider.com.
- Hvorfor er phosphorsyre diprotisk og ikke triprotisk? (2016, 11. marts). Gendannet fra chemistry.stackexchange.
- Zumdahl, S. S. (2018, 15. august). Oxysyre. Gendannet fra britannica.com.

Endnu ingen kommentarer