
Picrinsyrestruktur, syntese, egenskaber og anvendelser
Det pikrinsyre er en stærkt nitreret organisk kemisk forbindelse, hvis IUPAC-navn er 2,4,6-trinitrophenol. Dens molekylformel er C6Hto(IKKEto)3OH. Det er en meget sur phenol og kan findes som natrium, ammonium eller kaliumpikrat; det vil sige i sin ionform C6Hto(IKKEto)3På en.
Det er et fast stof med en stærk bitter smag, og derfra stammer det fra det græske ord 'prikos', som betyder bitter. Det findes som våde gule krystaller. Dens udtørring eller dehydrering er farlig, da det øger de ustabile egenskaber, der gør det eksplosivt.
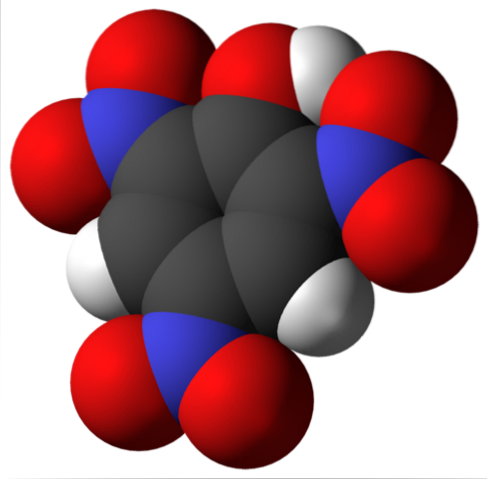
Picrinsyremolekylet er vist ovenfor. På billedet er det vanskeligt at genkende bindingerne og atomerne, fordi dette svarer til gengivelsen af dens overflade af Van der Waals. Det næste afsnit behandler den molekylære struktur mere detaljeret..
Nogle mellemforbindelser, forskellige pikratsalte og komplekser af pikrinsyre syntetiseres fra pikrinsyre..
Picrinsyre bruges som base til syntese af permanente gule farvestoffer. Nogle patologer og forskere bruger det til fiksering eller farvning af vævsafsnit og andre immunhistokemiske processer..
Det er meget nyttigt ved fremstilling af farmaceutiske produkter. Derudover bruges det til produktion af tændstikker og sprængstoffer. Det bruges også til at ætse metaller, fremstille farvet glas og ved kolorimetrisk bestemmelse af biologiske parametre, såsom kreatinin..
På den anden side er pikrinsyre irriterende, når den kommer i kontakt med huden, luftvejene, øjen- og fordøjelsesslimhinden. Ud over at skade huden kan det alvorligt påvirke nyrer, blod og lever blandt andre organer..
Artikelindeks
- 1 Struktur
- 1.1 Syrephenol
- 1.2 Krystalstruktur
- 2 Syntese
- 2.1 Direkte phenolnitrering
- 3 Fysiske og kemiske egenskaber
- 3.1 Molekylvægt
- 3.2 Fysisk udseende
- 3.3 Lugt
- 3.4 Smag
- 3.5 Smeltepunkt
- 3.6 Kogepunkt
- 3.7 Densitet
- 3.8 Opløselighed
- 3.9 Korrosivitet
- 3,10 pKa
- 3.11 ustabilitet
- 4 anvendelser
- 4.1 Forskning
- 4.2 Organisk kemi
- 4.3 I industrien
- 4.4 Militære anvendelser
- 5 Toksicitet
- 6 Referencer
Struktur

Det øverste billede viser alle bindingerne og selve strukturen af picrinsyremolekylet mere detaljeret. Den består af en phenol med tre nitrosubstituenter.
Det kan ses, at i grupperne NOto kvælstofatomet har en positiv delvis ladning og kræver derfor omgivelsernes elektrondensitet. Men den aromatiske ring tiltrækker også elektroner mod sig selv og før de tre NOto ender med at opgive en del af sin egen elektroniske tæthed.
Som en konsekvens af dette har OH-gruppens ilt tendens til mere at dele et af sine gratis elektroniske par for at levere den elektroniske mangel, som ringen har lidt; og derved dannes C = O-bindingen+-H. Denne delvis positive ladning på ilt svækker O-H-bindingen og øger surheden; det vil sige, det frigives som en hydrogenion, H+.
Syrephenol
Det er af denne grund, at denne forbindelse er en usædvanlig stærk (og reaktiv) syre, endnu mere end eddikesyre i sig selv. Imidlertid er forbindelsen faktisk en phenol, hvis surhed overstiger den for de andre phenoler; skyld, som netop nævnt, NO-substituenterneto.
Derfor, da det er en phenol, har OH-gruppen prioritet og dirigerer optællingen i strukturen. De tre NEJto de er placeret ved kulstofferne 2, 4 og 6 i den aromatiske ring med hensyn til OH. Det er her IUPAC-nomenklaturen for denne forbindelse er afledt: 2,4,6-Trinitrophenol (TNP).
Hvis grupperne ikke var der, NEJto, eller hvis der var et mindre antal af dem i ringen, ville O-H-bindingen svækkes mindre, og derfor ville forbindelsen have mindre surhed.
Krystalstruktur
Picrinsyremolekyler er arrangeret på en sådan måde, at de favoriserer deres intermolekylære interaktioner; enten til dannelse af hydrogenbindinger mellem OH- og NO-grupperto, dipol-dipolkræfter eller elektrostatiske frastødninger mellem elektronmangelregioner.
Det kan forventes, at grupperne IKKE gør detto de frastødte hinanden og ville orientere sig i retning af nærliggende aromatiske ringe. Ringene ville heller ikke være i stand til at stille hinanden oven på hinanden på grund af øgede elektrostatiske frastødninger..
Produktet af alle disse interaktioner formår picrinsyre at danne et tredimensionelt netværk, der definerer en krystal; hvis enhedscelle svarer til et krystallinsk system af orthorhombisk type.
Syntese
Oprindeligt blev det syntetiseret fra naturlige forbindelser såsom animalsk hornderivater, naturlige harpikser, blandt andre. Begyndende i 1841 er phenol blevet brugt som en forløber for pikrinsyre ved at følge forskellige veje eller gennem forskellige kemiske procedurer.
Som allerede nævnt er det en af de mest sure phenoler. For at syntetisere det gennemgår phenolen først en sulfoneringsproces efterfulgt af en nitreringsproces..
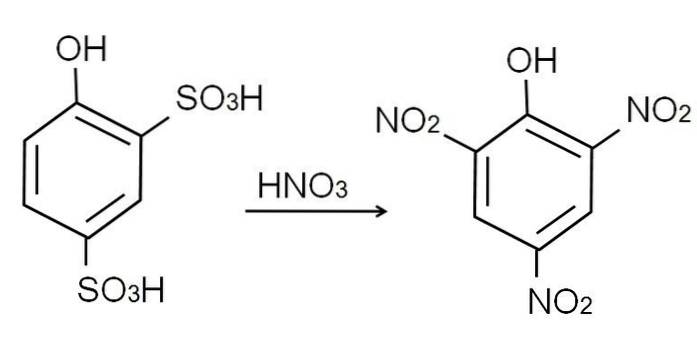
Sulfoneringen af vandfri phenol udføres ved at behandle phenolen med rygende svovlsyre, hvilket frembringer elektrofile aromatiske substitutioner af H med sulfonatgrupper, SO3H, i positionen -orto og -para med hensyn til OH-gruppen.
Dette produkt, 2,4-phenoldisulfonsyre, gennemgår nitreringsprocessen og behandler det med koncentreret salpetersyre. Dermed SO to de to grupper3H erstattes af nitrogrupper, NOto, og en tredjedel går ind i den anden nitroposition. Den følgende kemiske ligning illustrerer dette:
Direkte phenolnitrering
Phenolnitreringsprocessen kan ikke udføres direkte, da der genereres tjære med høj molekylvægt. Denne syntesemetode har brug for en meget omhyggelig kontrol af temperaturen, da den er meget eksoterm:
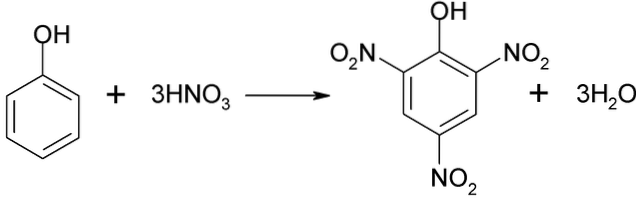
Picrinsyre kan opnås ved at udføre den direkte nitreringsproces af 2,4-dinitrophenol med salpetersyre.
En anden måde at syntetisere er behandling af benzen med salpetersyre og kviksølvnitrat..
Fysiske og kemiske egenskaber
Molekylær vægt
229,104 g / mol.
Fysisk fremtoning
Gul masse eller suspension af våde krystaller.
Lugt
Det er lugtfrit.
Smag
Det er meget bittert.
Smeltepunkt
122,5 ° C.
Kogepunkt
300 ° C Men når det smelter, eksploderer det.
Massefylde
1,77 g / ml.
Opløselighed
Det er en moderat vandopløselig forbindelse. Dette skyldes, at dets OH- og NO-grupperto de kan interagere med vandmolekyler gennem hydrogenbindinger; skønt den aromatiske ring er hydrofob og derfor forringer dens opløselighed.
Ætsende
Picrinsyre er generelt ætsende for metaller undtagen tin og aluminium.
pKa
0,38. Det er en stærk organisk syre.
Ustabilitet
Picrinsyre er kendetegnet ved ustabile egenskaber. Det udgør en risiko for miljøet, det er ustabilt, eksplosivt og giftigt.
Det skal opbevares tæt lukket for at undgå dehydrering, da pikrinsyre er meget eksplosiv, hvis det får lov til at tørre. Der skal udvises stor omhu med sin vandfri form, fordi den er meget følsom over for friktion, stød og varme..
Picrinsyre skal opbevares på et køligt, ventileret sted væk fra oxiderbare materialer. Det er irriterende ved kontakt med huden og slimhinderne, bør ikke indtages og er giftigt for kroppen.
Ansøgninger
Picrinsyre er blevet brugt i vid udstrækning inden for forskning, kemi, industri og militæret..
Efterforskning
Når det bruges som fiksativ til celler og væv, forbedrer det resultaterne af farvning af disse med syrefarvestoffer. Det sker med trichrome farvningsmetoder. Efter fiksering af vævet med formalin anbefales en ny fiksering med pikrinsyre..
På denne måde garanteres en intens og meget lys farvning af stofferne. Du får ikke gode resultater med grundlæggende farvestoffer. Der bør dog træffes forholdsregler, da pikrinsyre kan hydrolysere DNA, hvis den efterlades for længe..
Organisk kemi
-I organisk kemi bruges det som alkaliske picrater til at udføre identifikation og analyse af forskellige stoffer.
-Det bruges i analytisk kemi af metaller.
-I kliniske laboratorier bruges det til bestemmelse af serum- og urin-kreatininniveauer..
-Det er også blevet brugt i nogle af de reagenser, der blev brugt til analyse af glukoseniveauer..
I branchen
-På fotografisk industrieniveau er picrinsyre blevet brugt som sensibiliserende middel i fotografiske emulsioner. Det har været en del af produktionen af blandt andet pesticider, stærke insekticider.
-Picrinsyre bruges til f.eks. At syntetisere andre kemiske mellemprodukter, såsom chloropicrin og picraminsyre. Nogle lægemidler og farvestoffer til læderindustrien er fremstillet af disse forbindelser..
-Picrinsyre blev brugt til behandling af forbrændinger som et antiseptisk middel og andre forhold, før dets toksicitet blev tydelig.
-Vigtig komponent på grund af dens eksplosive karakter ved fremstilling af tændstikker og batterier.
Militære applikationer
-På grund af den høje eksplosivitet af pikrinsyre er den blevet brugt i ammunitionsanlæg til militære våben.
-Presset og smeltet pikrinsyre er blevet brugt i artilleriskaller, granater, bomber og miner.
-Picrinsyre-ammoniumsalt er blevet brugt som et eksplosivt stof, det er meget kraftigt, men mindre stabilt end TNT. I en periode blev det brugt som en komponent i raketbrændstof.
Toksicitet
Det er bevist, at det er meget giftigt for menneskekroppen og generelt for alle levende væsener.
Det anbefales at undgå indånding og indtagelse på grund af dets akutte orale toksicitet. Det forårsager også mutation i mikroorganismer. Det har toksiske virkninger på dyrelivet, pattedyr og miljøet generelt.
Referencer
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Wikipedia. (2018). Picrinsyre. Gendannet fra: en.wikipedia.org
- Purdue University. (2004). Picrinsyreeksplosion. Gendannet fra: chemed.chem.purdue.edu
- Krystallografi 365-projekt. (10. februar 2014). Mindre end blød gul - strukturen af picrinsyre. Gendannet fra: crystallography365.wordpress.com
- PubChem. (2019). Picric Acid. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Picric Acid. Methuen, London, Storbritannien.

Endnu ingen kommentarer