
Perbromsyre (HBrO4) egenskaber, risici og anvendelser

Det perbromsyre eller tetraoxo bromsyre er en uorganisk forbindelse med formlen HBrO4. Dens struktur er vist i figur 1 (EMBL-EBI, 2007). Det er en oxacid bromsyre, hvor den har oxidationstilstand 7+.
Det er ustabilt og kan ikke dannes ved fortrængning af chlor fra perchlorsyre som perbromsyre fremstilles; kan kun udføres ved protonering af perbromationen.
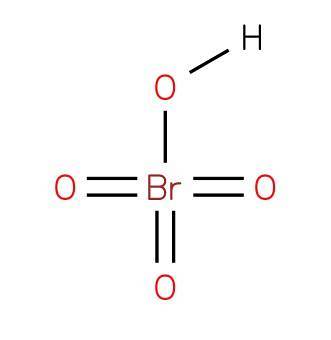
Perbromsyre er en stærk syre og et stærkt oxidationsmiddel. Det er den mindst stabile af halogenoxaciderne (VII). Nedbrydes hurtigt til bromsyre og ilt, der frigiver giftige brune brændampe.
Dens konjugatbase er perbromationen, som i modsætning til perchlorater ikke er tilgængelig ved elektrolyse. Det dannes ved at reagere bromater med ozon, eller når perbromsyre reagerer med baser (Ropp, 2013). En ny syntese af perbromater er blevet udviklet, som består af oxidation af bromat med fluor i alkalisk opløsning.
Brormand3- + Fto + HtoO → BrO4- + HF
Det blev opdaget ved henfaldet af en radioaktiv selenatprøve (SeO4-). Forbindelsen produceres også ved at udsætte bromatkrystaller for y-stråling (A. J. Downs, 1973)
Perbromsyre er en stærk monobasinsyre. Dens vandige opløsninger er stabile op til ca. 6 M (55% HBrO4) men nedbrydes ved højere koncentrationer (Appelman, 1969).
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber
Perbromsyre findes kun i opløsning. Det er en farveløs væske uden karakteristisk aroma (National Center for Biotechnology Information, 2017).
Forbindelsen har en molekylvægt på 144,908 g / mol. På grund af dets ustabilitet blev dets egenskaber beregnet ved beregningsmetoder, idet man opnåede et smelte- og kogepunkt på henholdsvis 204,77 ° C og 512,23 ° C..
Dens opløselighed i vand, også opnået ved beregningsberegninger, er i størrelsesordenen 1 x 106 mg pr. liter ved 25 ° C (Royal Society of Chemistry, 2015). Perbromsyre er en stærk syre, der kun har en proton for hvert heptavalent bromatom. I vandig opløsning adskilles hydroniumionen og BrO fuldstændigt4-.
Opløsninger med koncentrationer større end 6M (55% w / v) er ustabile i luften, og der sker en autokatalytisk nedbrydning af forbindelsen, som er komplet i koncentrationer på 80%. Denne nedbrydningsreaktion katalyseres også af metaller såsom Ce4+ og Ag+ (Egon Wiberg, 2001).
Reaktivitet og farer
Perbromsyre er en ustabil forbindelse, men den har stærke syreegenskaber, når den isoleres. Det er yderst farligt i tilfælde af hudkontakt (det er ætsende og irriterende), i kontakt med øjnene (irriterende) og i tilfælde af indtagelse. Også meget farligt i tilfælde af indånding.
Alvorlig overeksponering kan forårsage lungeskader, kvælning, bevidsthedstab eller død. Langvarig eksponering kan forårsage forbrændinger og sår på huden. Overeksponering ved indånding kan forårsage irritation af luftvejene..
Betændelse i øjet er kendetegnet ved rødme, vanding og kløe. Betændelse i huden er kendetegnet ved kløe, afskalning, rødme og lejlighedsvis blærer.
Stoffet er giftigt for nyrer, lunger og slimhinder. Gentagen eller langvarig eksponering for stoffet kan forårsage skader på disse organer..
I tilfælde af kontakt med øjnene skal du kontrollere, om du har kontaktlinser, og fjerne dem med det samme. Øjnene skal skylles med rindende vand i mindst 15 minutter, idet øjenlågene holdes åbne. Koldt vand kan bruges. Øjen salve bør ikke bruges.
Hvis kemikaliet kommer i kontakt med tøj, skal du fjerne det så hurtigt som muligt og beskytte dine egne hænder og krop. Anbring offeret under et sikkerhedsbrusebad.
Hvis kemikaliet akkumuleres på offerets udsatte hud, såsom hænder, vaskes den forurenede hud forsigtigt og omhyggeligt med rindende vand og ikke-slibende sæbe..
Syren kan også neutraliseres med fortyndet natriumhydroxid eller en svag base, såsom bagepulver. Søg lægehjælp, hvis irritationen vedvarer. Vask det forurenede tøj, inden det bruges igen.
Hvis hudkontakten er svær, skal den vaskes med et desinfektionsmiddel og sæbe og dække den forurenede hud med en antibakteriel creme..
I tilfælde af indånding skal offeret få lov til at hvile i et godt ventileret område. Hvis inhalationen er svær, skal offeret evakueres til et sikkert område hurtigst muligt..
Løsn stramt tøj såsom en skjortekrave, bælte eller slips. Hvis offeret har svært ved at trække vejret, skal der gives ilt. Hvis offeret ikke trækker vejret, udføres genoplivning fra mund til mund.
Der skal altid tages hensyn til, at det kan være farligt for den person, der yder hjælp til at give genoplivning fra mund til mund, når det inhalerede materiale er giftigt, smitsomt eller ætsende.
Fremkald ikke opkastning ved indtagelse. Løsn stramt tøj såsom skjortekraver, bælter eller bånd. Hvis offeret ikke trækker vejret, skal du udføre genoplivning fra mund til mund. I alle tilfælde skal du straks søge lægehjælp..
Ansøgninger
Hovedanvendelsen af perbromsyre er som et reduktionsmiddel i laboratoriet. Fortyndede perbromsyreopløsninger er langsomme oxidationsmidler på trods af deres store potentiale REDOX (+1.76 volt), men det er en bedre oxidant end perchlorsyre.
Perbromsyre kan langsomt oxidere bromid- og iodidioner. I opløsninger med 12 molær koncentration kan den hurtigt oxidere chloridionen og eksplodere i nærvær af salpetersyre. Opløsninger med 3 molær koncentration af perbromsyre kan let oxidere rustfrit stål.
Ved en temperatur på 100 ° C kan 6 molære opløsninger af perbromsyre oxidere manganionen (Mnto+) til permanganat (MnO4-). Reduktion af forbindelsen til brom kan opnås med tinchlorid (SnOto).
Den anden anvendelse af perbromsyre er syntese af perbromat-salte, såsom natriumperbromat eller kaliumperbromat..
Sidstnævnte er en forholdsvis stabil forbindelse, der modstår temperaturer på 274 ° C. Ved højere temperaturer reduceres det til kaliumbromat, i modsætning til perchlorat, som ved høje temperaturer producerer ilt og kaliumchlorid.
Referencer
- J. Downs, C. J. (1973). Kemien mellem klor, brom, jod og astatin. Oxford: Pergamon presse LTD.
- Appelman, E. H. (1969). Perbromsyre og perbromer: Syntese og nogle egenskaber. Uorganisk kemi 8 (2) , 223-227. Gendannet fra researchgate.net.
- Egon Wiberg, N. W. (2001). Uorganisk kemi. New York: Academic Press.
- EMBL-EBI. (2007, 28. oktober). perbromsyre. Gendannet fra ebi.ac.uk.
- National Center for Biotechnology Information. (2017, 30. april). PubChem Compound Database; CID = 192513. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Ropp, R.C. (2013). Encyclopædi af de alkaliske jordforbindelser. Oxford: Elsevier.
- Royal Society of Chemistry. (2015). Perbromsyre. Gendannet fra chemspider.com.


Endnu ingen kommentarer