
Hydrogen selenid (H2Se) struktur, egenskaber og anvendelser

Det brint selen eller hydrogenselenid er en uorganisk forbindelse, hvis kemiske formel er HtoJeg ved. Det er kovalent i naturen, og under normale temperatur- og trykforhold er det en farveløs gas; men med en stærk lugt, der kan genkendes til dets mindre tilstedeværelse. Kemisk er det et chalcogenid, så selen har en valens på -2 (Seto-).
Af alle seleniderne er HtoDet er det mest giftige, fordi dets molekyle er lille, og dets selenatom har mindre sterisk hindring, når det reagerer. På den anden side tillader dens lugt dem, der arbejder med det, at opdage det på stedet i tilfælde af lækage uden for laboratoriehætten..
Hydrogenselenid kan syntetiseres ved den direkte kombination af dets to grundstoffer: molekylært hydrogen, Hto, og metallisk selen. Det kan også opnås ved at opløse selenrige forbindelser, såsom jern (II) selenid, FeSe, i saltsyre..
På den anden side fremstilles hydrogenselenid ved opløsning af hydrogenselenid i vand; den første opløses i vand, mens den anden består af gasformige molekyler.
Dens vigtigste anvendelse er at være en kilde til selen i organisk og uorganisk syntese.
Artikelindeks
- 1 Struktur af hydrogenselenid
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Molekylær masse
- 2.3 Kogepunkt
- 2.4 Smeltepunkt
- 2.5 Damptryk
- 2.6 Tæthed
- 2,7 pKa
- 2.8 Opløselighed i vand
- 2.9 Opløselighed i andre opløsningsmidler
- 3 Nomenklatur
- 3.1 Selenid eller hydrid?
- 4 anvendelser
- 4.1 Metabolisk
- 4.2 Industriel
- 5 Referencer
Struktur af hydrogenselenid
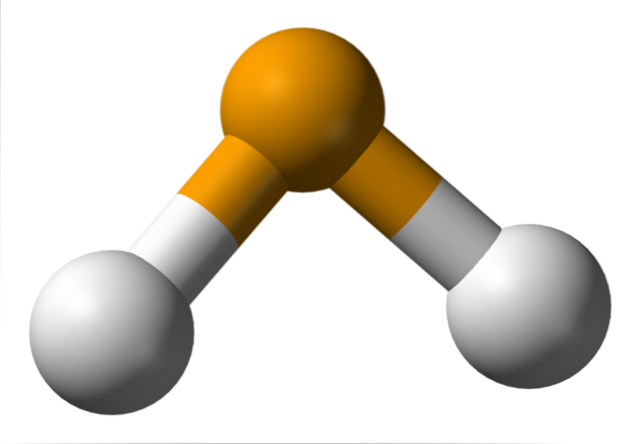
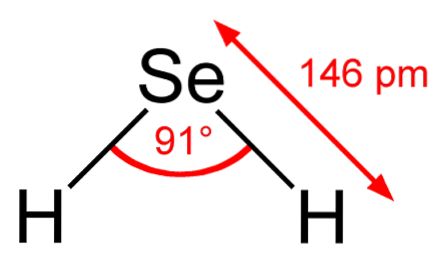
På det øverste billede observeres det, at molekylet af HtoDet har en vinkelgeometri, skønt dets vinkel på 91 ° får det til at ligne en L mere end en V. I denne model af sfærer og stænger er hydrogen- og selenatomer henholdsvis de hvide og gule sfærer..
Dette molekyle er som vist det i gasfasen; for hydrogenselenid. Når det opløses i vand, frigiver det en proton, og i opløsning har vi parret HSe- H3ELLER+; dette par ioner kommer til hydrogenselenid, betegnet som HtoSe (ac) for at skelne det fra hydrogenselenid, HtoSe (g).
Derfor er strukturerne mellem HtoSe (ac) og HtoSe (g) er meget forskellige; den første er omgivet af en vandig kugle og har ioniske ladninger, og den anden består af et agglomerat af molekyler i gasfasen.
Molekyler af HtoDe kan næppe interagere med hinanden ved meget svage dipol-dipol kræfter. Selv om selen er mindre elektronegativ end svovl, koncentrerer den en højere elektrondensitet ved at "tage den væk" fra hydrogenatomer..
Selenhydrid tabletter
Hvis molekylerne af HtoDe udsættes for et ekstraordinært pres (hundreder af GPa), teoretisk tvinges de til at størkne gennem dannelsen af Se-H-Se-bindinger; Disse er bindinger af tre centre og to elektroner (3c-2e), hvor hydrogen deltager. Derfor begynder molekylerne at danne polymere strukturer, der definerer et fast stof..
Under disse betingelser kan det faste stof beriges med mere hydrogen, hvilket fuldstændigt modificerer de resulterende strukturer. Derudover bliver sammensætningen type HnSe, hvor n varierer fra 3 til 6. Således har selenhydrider komprimeret af disse tryk og i nærværelse af hydrogen kemiske formler H3Se til H6Jeg ved.
Disse hydrogenberigede selenhydrider anslås at have superledende egenskaber.
Ejendomme
Fysisk fremtoning
Farveløs gas, der lugter ved rådne radise og rådne æg, hvis koncentrationen stiger. Dens lugt er værre og mere intens end hydrogensulfid (som allerede er ret ubehagelig). Dette er dog en god ting, da det hjælper med at lette detekteringen og reducerer risikoen for langvarig kontakt eller indånding..
Når det brænder, afgiver det et blåligt flammeprodukt af de elektroniske interaktioner i selenatomer.
Molekylær masse
80,98 g / mol.
Kogepunkt
-41 ° C.
Smeltepunkt
-66 ° C.
Damptryk
9,5 atm ved 21 ° C.
Massefylde
3.553 g / l.
pKtil
3,89.
Vandopløselighed
0,70 g / 100 ml. Dette bekræfter det faktum, at H-selenatomettoKan ikke danne mærkbare hydrogenbindinger med vandmolekyler.
Opløselighed i andre opløsningsmidler
-Opløselig i CSto, hvilket ikke er overraskende på grund af den kemiske analogi mellem selen og svovl.
-Opløselig i fosgen (ved lave temperaturer, da det koger ved 8 ° C).
Nomenklatur
Som allerede forklaret i de foregående afsnit varierer navnet på denne forbindelse afhængigt af om HtoDet er i luftformig fase eller opløst i vand. Når det er i vand, betegnes det som hydrogenselenid, som ikke er mere end en hydrat i uorganiske termer. I modsætning til luftformige molekyler er dens syrekarakter større.
Uanset om det er en gas eller opløst i vand, opretholder selenatomet de samme elektroniske egenskaber; for eksempel er dens valens -2, medmindre den gennemgår en oxidationsreaktion. Denne valens på -2 er grunden til, at den kaldes seleniaurochs hydrogen, da selenidanionen er Seto-; som er mere reaktiv og reducerende end Sto-, sulfid.
Hvis der anvendes systematisk nomenklatur, skal antallet af hydrogenatomer i forbindelsen specificeres. Således er HtoDet kaldes: selenid af gavhydrogen.
Selenid eller hydrid?
Nogle kilder henviser til det som et hydrid. Hvis det virkelig var, ville selen have en positiv ladning på +2, og brint ville have en negativ ladning på -1: SeHto (Jeg vedto+, H-). Selen er et mere elektronegativt atom end brint og ender derfor med at "hamstre" den højeste elektrondensitet i H-molekylettoJeg ved.
Imidlertid kan eksistensen af selenhydrid ikke teoretisk udelukkes. Faktisk med tilstedeværelsen af anionerne H- Det ville lette Se-H-Se obligationer, der er ansvarlige for de solide strukturer dannet ved enorme tryk ifølge beregningsstudier.
Ansøgninger
Metabolisk
Selvom det virker modstridende, på trods af H's store toksicitettoDet produceres i kroppen i den metaboliske vej af selen. Men så snart det er produceret, bruger celler det som et mellemprodukt i syntesen af selenoproteiner, eller det ender med at blive methyleret og udskilt; et af symptomerne på dette er smagen af hvidløg i munden.
Industriel
HtoDet bruges hovedsageligt til at tilføje selenatomer til faste strukturer, såsom halvledermaterialer; til organiske molekyler, såsom alkener og nitriler til syntese af organiske selenider; eller til en opløsning til udfældning af metalselenider.
Referencer
- Wikipedia. (2018). Brint selenid. Gendannet fra: en.wikipedia.org
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Atomi. (2012). Hydrogenselenid, HtoJeg ved. Gendannet fra: selenium.atomistry.com
- Tang Y. & col. (2017). Hydrogenselenid (HtoSe) Dopantgas til selenimplantation. 21. internationale konference om Ion Implantation Technology (IIT). Tainan, Taiwan.
- Kemisk formulering. (2018). Brint selenid. Gendannet fra: formulacionquimica.com
- PubChem. (2019). Brint selenid. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Zhang, S. et al. (2015). Fasediagram og højtemperatur superledningsevne for komprimerede selenhydrider. Sci. Rep. 5, 15433; doi: 10.1038 / srep15433.
- Acids.Info. (2019). Sæltesyre: egenskaber og anvendelser af denne hydracid. Gendannet fra: acidos.info/selenhidrico



Endnu ingen kommentarer