
Sulfonsyrestruktur, nomenklatur, egenskaber, anvendelser

Det kaldes sulfonsyre en hvilken som helst forbindelse, der hører til en familie af organiske syrer, der har en eller flere -SO-grupper3H. Visse forfattere indikerer, at moderforbindelsen er HS (= O)to-OH eller H-SO3H, kaldet af en eller anden "sulfonsyre", er dens eksistens imidlertid ikke bevist, heller ikke dens tautomer HO-S (= O) -OH kendt som "svovlsyre" (HtoSW3), hverken i opløsning eller i fast tilstand.
Sidstnævnte skyldes, at svovldioxidgas (IV) (SOtoi vandig opløsning omdannes til bisulfitioner (HSO3-) og pyrosulfit (StoELLER5to-) og ikke HS (= O)to-OH eller til HO-S (= O) -OH, som allerede er verificeret af mange kemiske forskere.
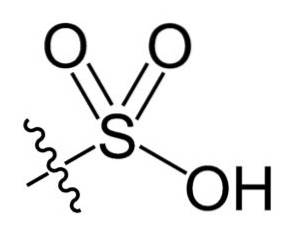
I den kemiske formel R-SO3H af sulfonsyrer kan gruppen R repræsentere carbonhydridskeletter, såsom alkan, alken, alkyn og / eller arene. Disse kan indeholde sekundære funktionaliteter såsom ester-, ether-, keton-, amino-, amido-, hydroxyl-, carboxyl- og phenolgrupper blandt mange andre..
Sulfonsyrer er stærke syrer, der kan sammenlignes med svovlsyre (HtoSW4). Resten af dets egenskaber afhænger dog stort set af R-gruppens natur..
Nogle har en tendens til at desulfonere ved høje temperaturer. Dette betyder at miste -SO-gruppen3H, især når R er en arene, det vil sige med en benzenring.
Sulfonsyrer har mange anvendelser afhængigt af deres kemiske formel. De bruges til at fremstille farvestoffer, blæk, polymerer, vaskemidler, overfladeaktive stoffer og som katalysatorer blandt mange andre anvendelser..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 4 Opnåelse
- 4.1 Arylsulfonsyrer
- 4.2 Alkylsulfonsyrer
- 5 anvendelser
- 5.1 Sulfonsyrer til overfladeaktive stoffer og rengøringsmidler
- 5.2 Farvestoffer baseret på sulfonsyrer
- 5.3 Amider baseret på sulfonsyrer
- 5.4 Fluorerede og chlorfluorerede sulfonsyrer
- 5.5 I biologiske anvendelser
- 5.6 I olieindustrien
- 5.7 I formulering af smøremidler og antikorrosiver
- 6 Referencer
Struktur
Sulfonsyrer har følgende generelle struktur:
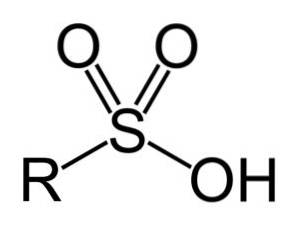
Nomenklatur
- Sulfonylgruppe: -SO3H
- Alkyl eller arylsulfonsyre: R-SO3H
Ejendomme
De er faste eller flydende afhængigt af gruppen R. Gasformige sulfonsyrer kendes ikke.
Deres fysiske og kemiske egenskaber afhænger af arten af R-gruppen. Til sammenligning præsenteres nogle fysiske egenskaber af forskellige sulfonsyrer, hvor smp. er smeltepunktet og f.eks. er kogepunktet ved et tryk på 1 mm Hg:
- Methansulfonsyre: smp. 20 ° C; f.eks. 122 ºC
- Ethansulfonsyre: smp. -17 ° C; f.eks. 123 ºC
- Propanesulfonsyre: smp. -37 ° C; f.eks. 159 ºC
- Butansulfonsyre: smp. -15 ° C; f.eks. 149 ºC
- Pentansulfonsyre: smp. -16 ° C; f.eks. 163 ºC
- Hexansulfonsyre: smp. 16 ° C; f.eks. 174 ºC
- Benzensulfonsyre: smp. 44 ° C; f.eks. 172 ºC (ved 0,1 mm Hg)
- P-toluensulfonsyre: smp. 106 ° C; f.eks. 182 ºC (ved 0,1 mm Hg)
- 1-naphthalensulfonsyre: smp. 78 ° C; f.eks. Det nedbrydes
- 2-naphthalensulfonsyre: smp. 91 ° C; f.eks. Det nedbrydes
- Trifluormethansulfonsyre: smp. ingen; f.eks. 162 ºC (ved 760 mm Hg)
De fleste er meget opløselige i vand.
Sulfonsyrer er endnu mere sure end carboxylsyrer. De har surhed svarende til svovlsyre. Opløs i vandigt natriumhydroxid og vandigt bicarbonat.
De har tendens til at gennemgå termisk nedbrydning, hvilket forårsager deres desulfonering. Imidlertid er adskillige af alkansulfonsyrerne termisk stabile. Især triflicsyre eller trifluormethansulfonsyre er en af de stærkeste og mest stabile syrer.
Opnåelse
Arylsulfonsyrer
Arylsulfonsyrer opnås generelt ved sulfoneringsprocessen, der består i tilsætning af et overskud af rygende svovlsyre (HtoSW4 + SW3) til den organiske forbindelse, som vi ønsker at sulfonere. For eksempel i tilfælde af benzen:
C6H6 + HtoSW4 <-> C6H5SW3H + HtoELLER
ArH + HtoSW4 <-> ArSO3H + HtoELLER
Sulfonering er en reversibel reaktion, for hvis vi tilsætter fortyndet syre til benzensulfonsyre og sender damp over blandingen, genereres SO-eliminationsreaktionen.3 og benzen destilleres gennem fordampning med damp, idet ligevægten forskydes mod desulfonering.
Sulfoneringsmidlet kan også være chlorsvovlsyre, sulfaminsyre eller sulfitioner..
Alkylsulfonsyrer
Disse fremstilles generelt ved sulfooxidation, dvs. behandling af alkylforbindelser med svovldioxid SOto og ilt Oto, eller direkte med svovltrioxid SO3.
RH + 2SOto + ELLERto + HtoELLER <--> R-SO3H + HtoSW4
Ansøgninger
Sulfonsyrer til overfladeaktive stoffer og rengøringsmidler
Alkylbenzensulfonsyrer anvendes til fremstilling af vaskemidler, der er en af de mest udbredte anvendelser.
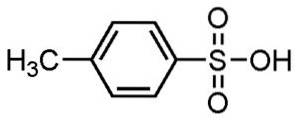
Anvendes til pulver- og flydende vaskemidler, lette eller tunge rengøringsmidler, håndsæber og shampoo.
De aktive komponenter er generelt lineære alkylbenzensulfonater og sulfonerede fede estere..
Almindelige overfladeaktive stoffer er alfa-olefinsulfonater, sulfobetainer, sulfosuccinater og alkyldiphenyletherdisulfonater, som alle er afledt af sulfonsyrer..
Disse overfladeaktive stoffer finder anvendelse i husholdningsrengøringsprodukter, kosmetik, emulsionspolymerisation og landbrugskemisk fremstilling..
Lignosulfonater er sulfonerede derivater af lignin, en bestanddel af træ, og anvendes som dispergeringsmidler, befugtningsmidler, bindemidler i fortove, betonblandinger og additiver i dyrefoder..
Et derivat af 2-naphthalensulfonsyre anvendes til at øge cementens flydbarhed og styrke..
Sulfonsyrebaserede farvestoffer
Disse er generelt karakteriseret ved at indeholde azogrupper (R-N = N-R).
Farvestoffer afledt af sulfonsyrer er nyttige i papirindustrien, blæk, såsom inkjet-trykning, tekstiler såsom bomuld og uld, kosmetik, sæber, rengøringsmidler, mad og læder..
Et derivat af 2-naphthalensulfonsyre anvendes også som ingrediens i farvestoffer til polyesterfibre og til garvning af læder..
Sulfonsyrebaserede amider
Acrylamidosulfonsyrer skiller sig ud i denne ansøgning, som anvendes i polymerer, ved elektroafsætning af metaller, som overfladeaktive stoffer og i gennemsigtige anti-tåge belægninger..
De bruges også til forbedret olieudvinding som jordfrigørelsesmidler, i hydrauliske cementblandinger og som aminoplasthærdningshærdende acceleratorer..
Nogle sulfonamider anvendes også i insekticidformler.
Fluorerede og chlorfluorerede sulfonsyrer
I denne gruppe er trifluormethansulfonsyre (CF3SW3H), også kaldet triflic acid. Denne forbindelse kan anvendes i organisk syntese og katalyse af polymerisationsreaktioner.
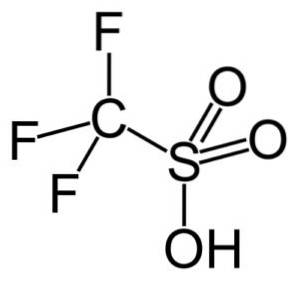
For eksempel anvendes det til polymerisation af aromatiske olefiner og til fremstilling af stærkt forgrenede paraffiniske carbonhydrider med et højt oktantal til anvendelse som brændstofadditiver..
En anden af dens anvendelser er i syntesen af ledende polymerer gennem doping af polyacetylen, hvilket producerer for eksempel halvledertype s.
Pentafluorethansulfonsyre (CF3CFtoSW3H), kendt som pentafil syre, anvendes som en organisk katalysator.
Triflic syre omsættes med antimon pentafluorid (SbF5) generering af den såkaldte "Magic Acid", en supersyrekatalysator, der tjener til alkylering og polymerisation.
Nafion-H er en ionbytterharpiks af en perfluoreret polymersulfonsyre. Det har karakteristikken ved at være inaktivt over for stærke syrer, stærke baser og reduktions- eller oxidationsmidler..
I biologiske anvendelser
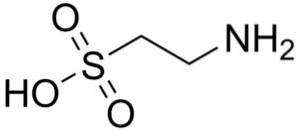
En af de få sulfonsyrer, der findes i naturen, er 2-aminoethansulfonsyre, bedre kendt som taurin, en essentiel aminosyre især til katte.
Syntetisk og naturlig taurin bruges som kosttilskud i foder til kæledyr og lægemidler..
Taurocholsyre er en bestanddel af galden og deltager i fordøjelsen af fedt. 8-Anilino-1-naphthalensulfonsyre, en syntetisk forbindelse, anvendes i undersøgelsen af proteiner.
Copolymerer af urinstof og biphenyldisulfonsyre er blevet anvendt som hæmmere af herpes simplex-virus.
Nogle derivater af sulfonsyrer, såsom sulfoneret polystyren og nogle azoforbindelser, har vist inhiberende egenskaber af det humane immundefektvirus eller HIV uden at være for giftige mod værtsceller.
I olieindustrien
Visse blandinger af petroleumderivater, der inkluderer en varieret kombination af aromater, paraffiner og polynukleære aromater, kan sulfoneres og derefter neutraliseres korrekt, hvilket genererer såkaldte petroleumssulfonater..
Disse petroleumssulfonater har den egenskab at sænke overfladespændingen af olie i vand. Derudover er produktionen meget billig.
Af denne grund injiceres petroleumssulfonater i eksisterende oliebrønde, hvilket hjælper med at genvinde råolie, der er fanget mellem klipper under overfladen.
I formuleringen af smøremidler og antikorrosiver
Magnesiumsulfonater anvendes i vid udstrækning i smøremiddelformuleringer som vaskemiddel-dispergerende additiver og for at forhindre slid..
Bariumsulfonater anvendes i antifriktionsbærende smøremidler, der anvendes i applikationer med høj hastighed. Natrium- og calciumsulfonater kan anvendes i gearsmøremidler og fedtstoffer for at forbedre ekstreme trykegenskaber.
Magnesiumsalte af sulfonsyrer er også nyttige til korrosionsbeskyttende anvendelser, såsom overtræk, fedt og harpiks..
Referencer
- Falk, Michael og Giguere, Paul A. (1958). Om svovlsyre. Canadian Journal of Chemistry, bind 36, 1958. Gendannet fra nrcresearchpress.com
- Betts, R.H. og Voss, R.H. (1970). Kinetikken for iltudveksling mellem sulfitionen og vandet. Canadian Journal of Chemistry, bind 48, 1970. Gendannet fra nrcresearchpress.com
- Bomuld, F.A. og Wilkinson, G. (1980). Avanceret uorganisk kemi. Fjerde udgave. Kapitel 16. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Bind 23. fjerde udgave. John Wiley & Sons.
- Kosswig, Kurt. (2012). Surfaktanter. Ullmann's Encyclopedia of Industrial Chemistry Vol. 35. Wiley-VCH Verlag GmbH & Co.

Endnu ingen kommentarer