
Elektrolytiske celledele, hvordan det fungerer og applikationer
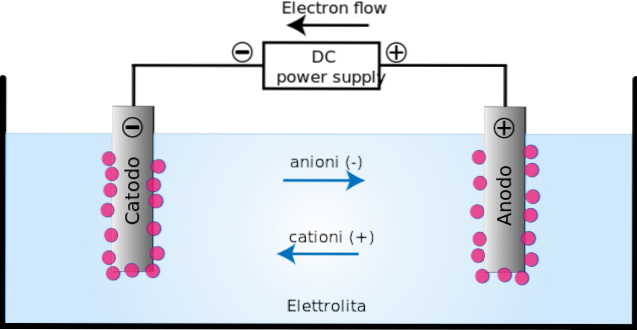
Det elektrolytisk celle det er et medium, hvor energi eller en elektrisk strøm bruges til at udføre en ikke-spontan oxidreduktionsreaktion. Den består af to elektroder: anoden og katoden.
Ved anoden (+) forekommer oxidation, da nogle grundstoffer eller forbindelser mister elektroner på dette sted; mens i katoden (-), reduktionen, da nogle grundstoffer eller forbindelser i den vinder elektroner.
I den elektrolytiske celle sker nedbrydningen af nogle stoffer, der tidligere er ioniseret, gennem en proces kendt som elektrolyse..
Anvendelsen af den elektriske strøm frembringer en orientering i ionernes bevægelse i den elektrolytiske celle. Positivt ladede ioner (kationer) migrerer mod ladningskatoden (-).
I mellemtiden migrerer de negativt ladede ioner (anioner) mod den ladede anode (+). Denne overførsel af opladning udgør en elektrisk strøm (topbillede). I dette tilfælde ledes den elektriske strøm af elektrolytopløsninger, der er til stede i den elektrolytiske cellebeholder..
Faradays lov om elektrolyse siger, at mængden af stof, der gennemgår oxidation eller reduktion ved hver elektrode, er direkte proportional med mængden af elektricitet, der passerer gennem cellen eller cellen..
Artikelindeks
- 1 dele
- 2 Hvordan fungerer en elektrolytisk celle?
- 2.1 Elektrolyse af smeltet natriumchlorid
- 2.2 Nedcelle
- 3 applikationer
- 3.1 Industrielle synteser
- 3.2 Belægning og raffinering af metaller
- 4 Referencer
Dele
En elektrolytisk celle består af en beholder, hvor det materiale, der gennemgår reaktionerne induceret af den elektriske ladning, afsættes..
Beholderen har et par elektroder, der er forbundet med et jævnstrømsbatteri. Elektroderne, der normalt bruges, er lavet af et inaktivt materiale, dvs. de deltager ikke i reaktionerne.
Et amperemeter kan tilsluttes i serie med batteriet for at måle intensiteten af strømmen, der strømmer gennem elektrolytopløsningen. Ligeledes placeres et voltmeter parallelt for at måle spændingsforskellen mellem paret af elektroder..
Hvordan fungerer en elektrolytisk celle?
Elektrolyse af smeltet natriumchlorid
Det foretrækkes at anvende smeltet natriumchlorid frem for fast natriumchlorid, da sidstnævnte ikke leder elektricitet. Ioner vibrerer i dine krystaller, men de er ikke frie til at bevæge sig.
Katode reaktion
Elektroder lavet af grafit, et inaktivt materiale, er forbundet til batteripolerne. En elektrode er forbundet til batteriets positive terminal, der udgør anoden (+).
I mellemtiden er den anden elektrode forbundet med batteriets minuspol, der udgør katoden (-). Når der strømmer strøm fra batteriet, observeres følgende:
Ved katoden (-) er der en reduktion af Na-ionen+, som når man vinder en elektron omdannes til metallisk Na:
Na+ + og- => Na (l)
Sølvhvid metallisk natrium flyder oven på smeltet natriumchlorid.
Anode reaktion
Tværtimod sker oxidationen af Cl-ionen ved anoden (+)-, da det mister elektroner og bliver til klorgas (Clto), en proces, der manifesteres ved udseendet ved anoden af en lysegrøn gas. Den reaktion, der opstår ved anoden, kan skitseres som følger:
2Cl- => Clto (g) + 2 e-
Dannelsen af metallisk Na- og Cl-gasto fra NaCl er det ikke en spontan proces, der kræver temperaturer højere end 800 ° C for at den skal forekomme. Den elektriske strøm leverer energien, så den angivne transformation finder sted ved elektroderne i den elektrolytiske celle..
Elektroner forbruges ved katoden (-) i reduktionsprocessen og produceres ved anoden (+) under oxidation. Derfor strømmer elektroner gennem det eksterne kredsløb i den elektrolytiske celle fra anode til katode..
Jævnstrømsbatteriet leverer energien til elektronerne til at strømme ikke-spontant fra anoden (+) til katoden (-).
Ned celle
Down-cellen er en tilpasning af den elektrolytiske celle, der er beskrevet og anvendes til industriel produktion af metallisk Na- og klorgas..
Downs elektrolytiske celle har enheder, der muliggør opsamling separat af metallisk natrium- og klorgas. Denne metode til produktion af metallisk natrium er stadig meget praktisk.
Når det flydende metalliske natrium er frigivet ved elektrolyse, drænes det, afkøles og skæres i blokke. Derefter opbevares det i et inaktivt medium, da natrium kan reagere eksplosivt ved kontakt med vand eller atmosfærisk ilt..
Klorgas produceres i industrien, hovedsageligt ved elektrolyse af natriumchlorid i en billigere proces end produktionen af metallisk natrium.
Ansøgninger
Industrielle synteser
-I industrien anvendes elektrolytiske celler til elektrorefinering og galvanisering af forskellige ikke-jernholdige metaller. Næsten al aluminium, kobber, zink og bly med høj renhed produceres industrielt i elektrolytiske celler..
-Brint produceres ved elektrolyse af vand. Denne kemiske procedure anvendes også til opnåelse af tungt vand (DtoELLER).
-Metaller som Na, K og Mg opnås ved elektrolyse af smeltede elektrolytter. Ikke-metaller som fluorider og chlorider opnås også ved elektrolyse. Også forbindelser som NaOH, KOH, NatoCO3 og KMnO4 syntetiseres ved den samme procedure.
Belægning og raffinering af metaller
-Processen med belægning af et ringere metal med et metal af højere kvalitet kaldes galvanisering. Formålet med dette er at forhindre korrosion af det nedre metal og gøre det mere attraktivt. Elektrolytiske celler anvendes til galvanisering til dette formål..
-Uren metaller kan raffineres ved elektrolyse. I tilfælde af kobber placeres meget tynde metalplader på katoden, og store stænger af urent kobber skal raffineres på anoden.
-Brugen af finerede genstande er almindelig i samfundet. Smykker og bordservice er normalt forsølvet; guld er elektroaflejret på smykker og elektriske kontakter. Mange genstande er dækket af kobber til dekorative formål.
-Biler har krom stålskærme og andre dele. Forkromning af en bilkofanger tager kun 3 sekunder forkromning for at producere en 0,0002 mm tyk skinnende overflade.
-Hurtig elektroafsætning af metal producerer ru, sorte overflader. Langsom elektroafsætning producerer glatte overflader. "Tin dåser" er lavet af stål belagt med tin ved elektrolyse. Nogle gange er disse dåser forkromet i en brøkdel af et sekund med tykkelsen af det ekstremt tynde kromlag.
Referencer
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Læring.
- eMedical Prep. (2018). Anvendelser af elektrolyse. Gendannet fra: emedicalprep.com
- Wikipedia. (2018). Elektrolytisk celle. Gendannet fra: en.wikipedia.org
- Prof. Shapley P. (2012). Galvaniske og elektrolytiske celler. Gendannet fra: butane.chem.uiuc.edu
- Bodner Research Web. (s.f.). Elektrolytiske celler. Gendannet fra: chemed.chem.purdue.edu


Endnu ingen kommentarer