
Dispergerede faseegenskaber og eksempler
Det spredt fase Det er den i en mindre andel, diskontinuerlig, og som er sammensat af aggregater af meget små partikler i en dispersion. I mellemtiden kaldes den mest rigelige og kontinuerlige fase, hvor de kolloide partikler ligger, dispersionsfasen..
Dispersioner klassificeres efter størrelsen på de partikler, der udgør den dispergerede fase, og der kan skelnes mellem tre typer dispersioner: grove dispersioner, kolloide opløsninger og ægte opløsninger..
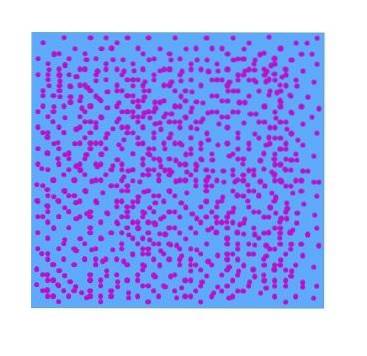
På billedet ovenfor kan en hypotetisk spredt fase af lilla partikler i vand ses. Som et resultat viser et glas fyldt med denne spredning ikke gennemsigtighed for synligt lys; det vil se det samme ud som en lilla flydende yoghurt. Typen af dispersioner varierer afhængigt af størrelsen af disse partikler.
Når de er "store" (10-7 m) vi taler om grove dispersioner, og de kan sedimentere ved tyngdekraftens virkning; kolloidale opløsninger, hvis deres størrelse er mellem 10-9 m og 10-6 m, hvilket kun gør dem synlige med et ultramikroskop eller elektronmikroskop; og ægte løsninger, hvis deres størrelse er mindre end 10-9 m, at være i stand til at krydse membraner.
De sande løsninger er derfor alle dem, der er populært kendt, såsom eddike eller sukkervand.
Artikelindeks
- 1 Karakteristika for den spredte fase
- 1.1 Brownsk bevægelse og Tyndall-effekten
- 1.2 Heterogenitet
- 1.3 Stabilitet
- 2 Eksempler
- 2.1 Faste løsninger
- 2.2 Faste emulsioner
- 2.3 Fast skum
- 2.4 Soler og geler
- 2.5 Emulsioner
- 2.6 Skum
- 2.7 Faste aerosoler
- 2.8 Flydende aerosoler
- 2.9 Ægte løsninger
- 3 Referencer
Karakteristika for den spredte fase
Løsningerne udgør et særligt tilfælde af dispersionerne, idet de er af stor interesse for viden om de levende væseners fysiokemi. De fleste biologiske stoffer, både intracellulære og ekstracellulære, er i form af såkaldte dispersioner.
Brownsk bevægelse og Tyndall-effekten
Partiklerne i den spredte fase af kolloide opløsninger har en lille størrelse, der gør deres sedimentering formidlet af tyngdekraften vanskelig. Desuden bevæger partiklerne sig konstant i en tilfældig bevægelse og kolliderer med hinanden, hvilket også gør det vanskeligt for dem at sætte sig. Denne type bevægelse er kendt som en brownian.
På grund af den relativt store størrelse af de dispergerede fasepartikler har kolloide opløsninger et uklart eller endda uigennemsigtigt udseende. Dette skyldes, at lys spredes, når det passerer gennem kolloidet, et fænomen kendt som Tyndall-effekten..
Heterogenitet
Kolloidale systemer er inhomogene systemer, da den spredte fase består af partikler med en diameter mellem 10-9 m og 10-6 m. I mellemtiden har partiklerne af opløsningerne en mindre størrelse, generelt mindre end 10-9 m.
Partikler fra den spredte fase af kolloide opløsninger kan passere gennem filterpapiret og lerfiltret. Men de kan ikke passere gennem dialysemembraner som cellofan, kapillært endotel og kollodion..
I nogle tilfælde er de partikler, der udgør den spredte fase, proteiner. Når de er i den vandige fase, foldes proteinerne og efterlader den hydrofile del udad for en større interaktion med vand gennem ion-dipolo-kræfter eller med dannelsen af hydrogenbindinger..
Proteiner danner et retikulært system inde i celler, der er i stand til at sekvestre en del af dispergeringsmidlet. Derudover tjener proteinenes overflade til at binde små molekyler, der giver den en overfladisk elektrisk ladning, som begrænser interaktionen mellem proteinmolekylerne og forhindrer dem i at danne blodpropper, der forårsager deres sedimentering..
Stabilitet
Kolloider klassificeres efter tiltrækningen mellem den dispergerede fase og dispergeringsfasen. Hvis dispersionsfasen er flydende, klassificeres kolloide systemer som soler. Disse er opdelt i lyofile og lyofobe.
Lyofile kolloider kan danne ægte løsninger og er termodynamisk stabile. På den anden side kan lyofobe kolloider danne to faser, da de er ustabile; men stabil fra det kinetiske synspunkt. Dette giver dem mulighed for at forblive i spredt tilstand i lang tid..
Eksempler
Både spredningsfasen og den spredte fase kan forekomme i de tre fysiske tilstande af stof, det vil sige: fast, flydende eller gasformig..
Normalt er den kontinuerlige eller dispergerende fase i flydende tilstand, men der kan findes kolloider, hvis komponenter er i andre tilstande af materialet..
Mulighederne for at kombinere dispergeringsfasen og den spredte fase i disse fysiske tilstande er ni.
Hver enkelt forklares med nogle respektive eksempler.
Solide løsninger
Når dispergeringsfasen er fast, kan den kombineres med en dispergeret fase i fast tilstand og danne såkaldte faste opløsninger..
Eksempler på disse interaktioner er: mange legeringer af stål med andre metaller, nogle farvede perler, forstærket gummi, porcelæn og pigmenteret plast..
Faste emulsioner
Faststof-dispergeringsfasen kan kombineres med en flydende dispergeret fase, der danner såkaldte faste emulsioner. Eksempler på disse interaktioner er: ost, smør og gelé.
Massivt skum
Dispergeringsfasen som et fast stof kan kombineres med en dispergeret fase i gasform, der udgør de såkaldte faste skum. Eksempler på disse interaktioner er: svamp, gummi, pimpsten og skumgummi..
Soler og geler
Dispergeringsfasen i flydende tilstand kombineres med den dispergerede fase i fast tilstand og danner solerne og gelerne. Eksempler på disse interaktioner er: mælk af magnesia, maling, mudder og budding..
Emulsioner
Dispergeringsfasen i flydende tilstand kombineres med den dispergerede fase også i flydende tilstand og producerer såkaldte emulsioner. Eksempler på disse interaktioner er: mælk, ansigtscreme, salatdressinger og mayonnaise..
Skum
Dispergeringsfasen i flydende tilstand kombineres med den dispergerede fase i gasform og danner skum. Eksempler på disse interaktioner er: barbercreme, flødeskum og ølskum.
Faste aerosoler
Dispergeringsfasen i gasformig tilstand kombineres med den dispergerede fase i fast tilstand, hvilket giver anledning til de såkaldte faste aerosoler. Eksempler på disse interaktioner er: røg, vira, korpuskulære materialer i luften, materialer udsendt af biludstødningsrør.
Flydende aerosoler
Dispergeringsfasen i gasform kan kombineres med den dispergerede fase i flydende tilstand, hvilket udgør de såkaldte flydende aerosoler. Eksempler på disse interaktioner er: tåge, tåge og dug.
Ægte løsninger
Dispergeringsfasen i gasform kan kombineres med gasfasen i gasform og danner de gasformige blandinger, der er ægte opløsninger og ikke kolloide systemer. Eksempler på disse interaktioner er: luft og gas fra belysning.
Referencer
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Læring.
- Toppr. (s.f.). Klassificering af kolloider. Gendannet fra: toppr.com
- Jiménez Vargas, J og Macarulla. J. M. (1984). Physiological Physicochemistry, Sixth Edition. Redaktionel Interamericana.
- Merriam-Webster. (2018). Medicinsk definition af spredt fase. Gendannet fra: merriam-webster.com
- Madhusha. (2017, 15. november). Forskellen mellem spredt fase og spredningsmedium. Gendannet fra: pediaa.com


Endnu ingen kommentarer