
Jodsyre (HIO2) egenskaber og anvendelser

Det jodsyre Det er en kemisk forbindelse med formlen HIO2. Denne syre såvel som dens salte (kendt som ioditter) er ekstremt ustabile forbindelser, der er blevet observeret, men aldrig isoleret.
Det er en svag syre, hvilket betyder, at den ikke adskiller sig fuldstændigt. I anionen er iod i oxidationstilstand III og har en struktur, der er analog med klorsyre eller bromsyre, som illustreret i figur 1.
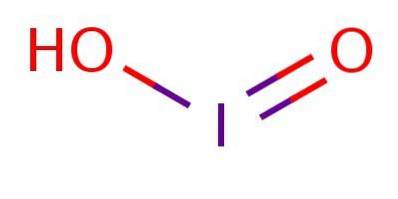
På trods af at forbindelsen er ustabil, er iodsyre og dens ioditsalte blevet påvist som mellemprodukter i omdannelsen mellem iodider (I-) og iodater (IO3-).
Dens ustabilitet skyldes en dismutationsreaktion (eller disproportion) for at danne hypoiodoid syre og iodsyre, som er analog med klorsyre og bromsyre på følgende måde:
2HIO2 -> HIO + HIO3
I Napoli i 1823 skrev videnskabsmanden Luigi Sementini et brev til E. Daniell, sekretær for den kongelige institution i London, hvor han forklarede en metode til opnåelse af jodsyre.
I brevet sagde han, at i betragtning af at dannelsen af salpetersyre var, kombinerede salpetersyre med det, han kaldte salpetersyre (muligvis NtoO), iodsyre kunne dannes på samme måde ved at reagere iodsyre med iodoxid, en forbindelse, som han havde opdaget.
Dermed opnåede han en gulbrun væske, der mistede sin farve ved kontakt med atmosfæren (Sir David Brewster, 1902).
Senere opdagede videnskabsmanden M. Wöhler, at Sementinis syre er en blanding af iodchlorid og molekylært iod, da iodoxidet anvendt i reaktionen blev fremstillet med kaliumchlorat (Brande, 1828).
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 anvendelser
- 2.1 Nukleofil acylering
- 2.2 Demutationsreaktioner
- 2.3 Bray-Liebhafsky-reaktioner
- 3 Referencer
Fysiske og kemiske egenskaber
Som nævnt ovenfor er iodsyre en ustabil forbindelse, der ikke er isoleret, så dens fysiske og kemiske egenskaber opnås teoretisk gennem beregningsberegninger og simuleringer (Royal Society of Chemistry, 2015).
Jodsyre har en molekylvægt på 175,91 g / mol, en densitet på 4,62 g / ml i fast tilstand, et smeltepunkt på 110 grader Celsius (jodsyre, 2013-2016).
Det har også en opløselighed i vand på 269 g / 100 ml ved 20 grader Celsius (er en svag syre), har en pKa på 0,75 og har en magnetisk følsomhed på -48,0 · 10-6 cm3 / mol (National Center for Biotechnology Information, sf).
Da jodsyre er en ustabil forbindelse, der ikke er isoleret, er der ingen risiko for at håndtere den. Det er blevet fundet ved teoretiske beregninger, at iodsyre ikke er brandfarlig..
Ansøgninger
Nukleofil acylering
Jodsyre anvendes som en nukleofil i nukleofil acyleringsreaktioner. Eksemplet er givet med acylering af trifluoracetyler, såsom 2,2,2-trifluoracetylbromid, 2,2,2-trifluoracetylchlorid, 2,2,2-trifluoracetylfluorid og 2,2,2-trifluoracetyliodid til dannelse af iodosyl 2,2,2 trifluoracetat som illustreret i henholdsvis figur 2.1, 2.2, 2.3 og 2.4.

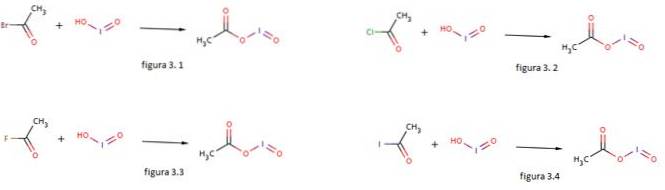
Jodsyre bruges også som en nukleofil til dannelse af iodosylacetat ved at reagere med acetylbromid, acetylchlorid, acetylfluorid og acetyliodid som vist i henholdsvis figur 3.1, 3.2, 3.3 og 3.4 (GNU Free Documentation, sf).
Demutationsreaktioner
Demutation eller disproportioneringsreaktioner er en type oxidreduktionsreaktion, hvor stoffet, der oxideres, er det samme som reduceres.
I tilfælde af halogener, da de har oxidationstilstande på -1, 1, 3, 5 og 7, kan forskellige produkter af dismutationsreaktioner opnås afhængigt af de anvendte betingelser..
I tilfælde af iodsyre er eksemplet på, hvordan det reagerer til dannelse af hypoiodinsyre og iodsyre af formen.
2HIO2 -> HIO + HIO3
Nylige undersøgelser har analyseret nedbrydningsreaktionen af iodsyre ved at måle koncentrationerne af protoner (H+), iodat (IO3-og den sure hypoioditkation (HtoIO+) for bedre at forstå mekanismen ved jodsyredisperring (Smiljana Marković, 2015).
En opløsning blev fremstillet indeholdende den mellemliggende art I3+. En blanding af iod (I) og iod (III) blev fremstillet ved opløsning af iod (Ito) og kaliumiodid (KIO3i forholdet 1: 5 i koncentreret svovlsyre (96%). I denne opløsning fortsætter en kompleks reaktion, som kan beskrives ved reaktionen:
jegto + 3IO3- + 8H+ -> 5IO+ + HtoELLER
Arter I3+ de er kun stabile i nærværelse af tilsat overskydende iodat. Jod forhindrer dannelsen af I3+. IO-ionen+ Opnået i form af jodsulfat (IO) toSW4), nedbrydes hurtigt i sur vandig opløsning og form I3+, repræsenteret som syre-HIOto eller den ioniske art IO3-. Derefter blev der udført en spektroskopisk analyse for at bestemme værdien af koncentrationerne af ionerne af interesse..
Dette præsenterede en procedure til evaluering af pseudo-ligevægtskoncentrationer af hydrogen, iodat og H-ioner.toJEG HØRTE+, Kinetiske og katalytiske arter, der er vigtige i processen med disproportionering af iodsyre, HIOto.
Bray-Liebhafsky-reaktioner
En kemisk ur eller svingningsreaktion er en kompleks blanding af reagerende kemiske forbindelser, hvor koncentrationen af en eller flere komponenter ændres periodisk, eller når pludselige ændringer i egenskaber forekommer efter en forudsigelig induktionstid.
De er en klasse af reaktioner, der tjener som et eksempel på ikke-ligevægts termodynamik, hvilket resulterer i etableringen af en ikke-lineær oscillator. De er teoretisk vigtige, fordi de viser, at kemiske reaktioner ikke behøver at blive domineret af ligevægtstermodynamisk opførsel..
Bray-Liebhafsky-reaktionen er et kemisk ur, der først blev beskrevet af William C. Bray i 1921 og er den første svingningsreaktion i en omrørt homogen opløsning..
Jodsyre anvendes eksperimentelt til at studere denne type reaktion, når den oxideres med hydrogenperoxid, hvilket finder en bedre overensstemmelse mellem den teoretiske model og eksperimentelle observationer (Ljiljana Kolar-Anić, 1992).
Referencer
- Brande, W. T. (1828). En kemikaliehåndbog på basis af professor Brande's. Boston: University of Harvard.
- GNU-fri dokumentation. (s.f.). jodsyre. Hentet fra chemsink.com: chemsink.com
- jodsyre. (2013-2016). Hentet fra molbase.com: molbase.com
- Ljiljana Kolar-Anić, G. S. (1992). Mekanisme ved Bray-Liebhafsky-reaktionen: virkning af oxidationen af jodsyre med hydrogenperoxid. Chem. Soc., Faraday Trans 1992,88, 2343-2349. http://pubs.rsc.org/da/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- National Center for Biotechnology Information. (nd). PubChem Compound Database; CID = 166623. Hentet fra pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Jodsyre ChemSpider ID145806. Hentet fra ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). London og Edinburgh Philosophical Magazine og Journal of Science. London: University of London.
- Smiljana Marković, R. K. (2015). Disproportioneringsreaktion af jodsyre, HOIO. Bestemmelse af koncentrationerne af de relevante ionarter H +, H2OI + og IO3 -.



Endnu ingen kommentarer