
Syreegenskaber og eksempler

Det syrer de er forbindelser med en høj tendens til at donere protoner eller acceptere et par elektroner. Der er mange definitioner (Bronsted, Arrhenius, Lewis), der karakteriserer syrenes egenskaber, og hver af dem suppleres for at opbygge et globalt billede af denne type forbindelser..
Fra ovenstående perspektiv kan alle kendte stoffer være sure, men kun de, der skiller sig langt ud over de andre, betragtes som sådanne. Med andre ord: hvis et stof er en ekstremt svag protondonor sammenlignet med for eksempel vand, kan det siges, at det ikke er en syre.

Dette er tilfældet, hvad er syrerne og deres naturlige kilder? Et typisk eksempel på dem findes i mange frugter: såsom citrus. Limonader har deres karakteristiske smag på grund af citronsyre og andre komponenter.
Tungen kan registrere tilstedeværelsen af syrer, ligesom det gør med andre smagsstoffer. Afhængig af surhedsgraden af disse forbindelser bliver smagen mere utålelig. På denne måde fungerer tungen som en organoleptisk meter til koncentrationen af syrer, specifikt koncentrationen af hydroniumion (H3ELLER+).
På den anden side findes syrer ikke kun i mad, men også i levende organismer. Ligeledes indeholder jord stoffer, der kan karakterisere dem som sure; sådan er tilfældet med aluminium og andre metalkationer.
Artikelindeks
- 1 Karakteristik af syrer
- 1.1 - Fysiske egenskaber
- 1.2 - Evne til at generere protoner
- 1.3 - De har hydrogener med ringe elektrontæthed
- 1.4 - Styrke eller surhedskonstant
- 1.5 - Det har meget stabile konjugatbaser
- 1.6 - De kan have positive ladninger
- 1.7 - Dine opløsninger har pH-værdier lavere end 7
- 1.8 - Evne til at neutralisere baser
- 2 Stærke syrer og svage syrer
- 3 Eksempler på syrer
- 3.1 Hydrogenhalogenider
- 3.2 Oxosyrer
- 3.3 Super syrer
- 3.4 Organiske syrer
- 4 Referencer
Karakteristik af syrer
Hvilke egenskaber skal en forbindelse ifølge eksisterende definitioner have for at blive betragtet som sur??
Skal være i stand til at generere H-ioner+ og OH- når det opløses i vand (Arrhenius), skal det meget let donere protoner til andre arter (Bronsted), eller endelig skal det være i stand til at acceptere et par elektroner og oplade sig selv negativt (Lewis).
Disse egenskaber er imidlertid tæt knyttet til den kemiske struktur. Derfor, ved at lære at analysere det, er det muligt at udlede dens surhedsgrad eller et par forbindelser, hvilken af de to er de mest sure..
- Fysiske egenskaber
Syrer har en smag, der er redundansen værd, syre og deres lugt brænder ofte næseborene. De er væsker med en klæbrig eller olieagtig struktur og har evnen til at ændre farven på lakmuspapir og methylorange til rød (Egenskaber for syrer og baser, S.F.).
- Evne til at generere protoner
I 1923 introducerede den danske kemiker Johannes Nicolaus Brønsted og den engelske kemiker Thomas Martin Lowry teorien om Brønsted og Lowry om, at enhver forbindelse, der kan overføre en proton til en hvilken som helst anden forbindelse, er en syre (Encyclopædia Britannica, 1998). For eksempel i tilfælde af saltsyre:
HCI → H+ + Cl-
Brønsted og Lowrys teori forklarede ikke visse stoffers sure opførsel. I 1923 introducerede den amerikanske kemiker Gilbert N. Lewis sin teori, hvor en syre betragtes som enhver forbindelse, der i en kemisk reaktion er i stand til at forbinde et par elektroner, der ikke deles i et andet molekyle (Encyclopædia Britannica, 1998).
På denne måde ioner som Cuto+, troto+ og troen3+ De har evnen til at binde med par frie elektroner, for eksempel fra vand til at producere protoner på den måde:
Cuto+ + 2HtoO → Cu (OH)to + 2H+
- De har hydrogen, der er ringe i elektrondensitet
For methanmolekylet, CH4, ingen af dets hydrogener er elektronisk mangelfuld. Dette skyldes, at elektronegativitetsforskellen mellem kulstof og brint er meget lille. Men hvis et af H-atomerne blev erstattet af et fluor, ville der være en mærkbar ændring i dipolmomentet: HtoFC-H.
H den oplever en forskydning af sin elektronsky mod det tilstødende atom bundet til F, hvilket er det samme, δ + stiger. Igen, hvis en anden H erstattes af en anden F, så vil molekylet se ud som: HFtoC-H.
Nu er δ + endnu højere, da de er to stærkt elektronegative F-atomer, der trækker elektrondensitet fra C, og sidstnævnte følgelig fra C H. Hvis substitutionsprocessen fortsatte, ville den endelig opnås: F3C-H.
I dette sidste molekyle H præsenterer som en konsekvens af de tre tilstødende F-atomer en markant elektronisk mangel. Denne δ + går ikke ubemærket hen af nogen art, der er rig nok på elektroner til at fjerne dette H og dermed F3CH bliver negativt ladet:
F3C-H + : N- (negativ art) => F3C:- + HN
Ovenstående kemiske ligning kan også overvejes på denne måde: F3CH donerer en proton (H.+, det H en gang løsrevet fra molekylet) a: N; o, F3CH får et par elektroner fra H som et andet par blev doneret til sidstnævnte fra: N-.
- Surhedsstyrke eller konstant
Hvor meget F3C:- er det til stede i løsningen? Eller hvor mange molekyler af F3CH kan donere hydrogensyre til N? For at besvare disse spørgsmål er det nødvendigt at bestemme koncentrationen af F3C:- eller fra HN og ved hjælp af en matematisk ligning etablere en numerisk værdi kaldet surhedskonstanten Ka.
Jo flere molekyler af F3C:- eller HN produceres, jo mere syre vil være F3CH og større er dens Ka. På denne måde hjælper Ka med at afklare kvantitativt, hvilke forbindelser der er surere end andre; og ligeledes kasserer den som syrer dem, hvis Ka har en ekstremt lille orden.
Nogle Ka kan have værdier omkring 10-1 og 10-5, og andre, værdier milliontedele mindre som 10-femten og 10-35. Det kan så siges, at sidstnævnte, når de nævnte surhedskonstanter er, er ekstremt svage syrer og kan kasseres som sådan..
Så hvilke af de følgende molekyler har den højeste Ka: CH4, CH3F, CHtoFto eller CHF3? Svaret ligger i manglen på elektrondensitet, δ +, i deres hydrogener..
Målinger
Men hvad er kriterierne for standardisering af Ka-målinger? Dens værdi kan variere enormt, afhængigt af hvilken art der modtager H+. For eksempel, hvis: N er en stærk base, vil Ka være stor; men hvis det tværtimod er en meget svag base, vil Ka være lille.
Ka-målinger foretages ved hjælp af den mest almindelige og svageste af alle baser (og syrer): vand. Afhængig af graden af donation af H+ til H-molekylertoEller ved 25 ° C og ved et tryk på en atmosfære er standardbetingelserne fastlagt for at bestemme surhedskonstanterne for alle forbindelserne.
Fra dette opstår et repertoire af tabeller med surhedskonstanter for mange forbindelser, både uorganiske og organiske..
- Det har meget stabile konjugerede baser
Syrer har stærkt elektronegative atomer eller enheder (aromatiske ringe) i deres kemiske strukturer, der tiltrækker elektrondensiteter fra omgivende hydrogen, hvilket får dem til at blive delvist positive og reaktive over for en base.
Når protonerne først donerer, bliver syren til en konjugatbase; det vil sige en negativ art, der er i stand til at acceptere H+ eller doner et par elektroner. I eksemplet med CF-molekylet3H dens konjugatbase er CF3-:
CF3- + HN <=> CHF3 + : N-
Ja CF3- er en meget stabil konjugatbase, vil ligevægten forskydes mere til venstre end til højre. Jo mere stabil den er, jo mere reaktiv og sur vil syren også være..
Hvordan ved du, hvor stabile de er? Det hele afhænger af, hvordan de håndterer den nye negative ladning. Hvis de kan aflokalisere det eller diffundere den stigende elektrondensitet effektivt, vil den ikke være tilgængelig til brug i binding med basen H..
- De kan have positive ladninger
Ikke alle syrer har elektronmangelhydrogener, men de kan også have andre atomer, der er i stand til at acceptere elektroner med eller uden en positiv ladning..
Hvordan er dette? For eksempel i bortrifluorid, BF3, B-atomet mangler en valensoktet, så det kan danne en binding med ethvert atom, der giver det et par elektroner. Hvis en anion F- runde i sin nærhed forekommer følgende kemiske reaktion:
BF3 + F- => BF4-
På den anden side er gratis metalkationer, såsom Al3+, Znto+, Na+, osv. betragtes som sure, da de fra deres omgivelser kan acceptere dative (koordinerings) bindinger af elektronrige arter. De reagerer også med OH-ioner- at udfældes som metalhydroxider:
Znto+(aq) + 2OH-(ac) => Zn (OH)to(s)
Alle disse er kendt som Lewis-syrer, mens de, der donerer protoner, er Bronsted-syrer..
- Deres opløsninger har pH-værdier mindre end 7
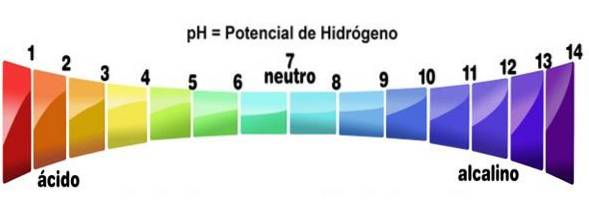
Mere specifikt, når en syre opløses i et hvilket som helst opløsningsmiddel (der ikke neutraliserer det mærkbart), genererer den opløsninger med en pH-værdi lavere end 3, selvom de under 7 betragtes som meget svage syrer..
Dette kan verificeres ved hjælp af en syre-base-indikator, såsom phenolphthalein, universalindikator eller lilla kåljuice. De forbindelser, der omdanner farverne til de, der er angivet for lav pH, behandles som syrer. Dette er en af de enkleste tests for at bestemme tilstedeværelsen af dem..
Det samme kan for eksempel gøres for forskellige jordprøver fra forskellige dele af verden, hvorved deres pH-værdier bestemmes for sammen med andre variabler at karakterisere dem..
Og endelig har alle syrer sure smagsstoffer, så længe de ikke er så koncentrerede, at de irreversibelt brænder tungens væv..
- Evne til at neutralisere baser
Arrhenius foreslår i sin teori, at syrer ved at være i stand til at danne protoner reagerer med hydroxylen af baserne for at danne salt og vand på følgende måde:
HCI + NaOH → NaCl + HtoELLER.
Denne reaktion kaldes neutralisering og er grundlaget for den analytiske teknik kaldet titrering (Bruce Mahan, 1990).
Stærke syrer og svage syrer
Syrer klassificeres i stærke syrer og svage syrer. Styrken af en syre er forbundet med dens ligevægtskonstant, derfor kaldes disse konstanter i tilfælde af syrer surhedskonstanter Ka.
Således har stærke syrer en stor syrekonstant, så de har en tendens til at adskille sig fuldstændigt. Eksempler på disse syrer er svovlsyre, saltsyre og salpetersyre, hvis syrekonstanter er så store, at de ikke kan måles i vand..
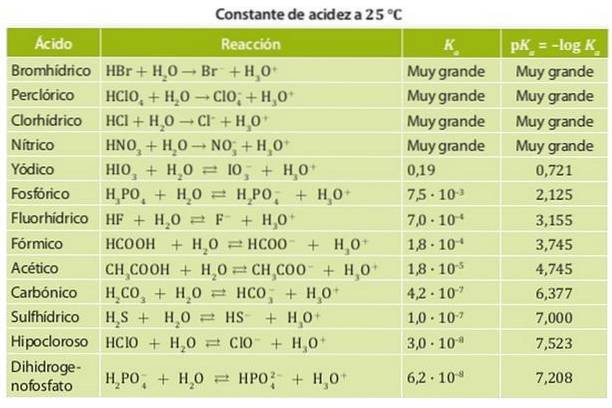
På den anden side er en svag syre en, hvis dissociationskonstant er lav, så den er i kemisk ligevægt. Eksempler på disse syrer er eddikesyre og mælkesyre og salpetersyre, hvis surhedskonstanter er i størrelsesordenen 10-4. Figur 1 viser de forskellige surhedskonstanter for forskellige syrer.
Eksempler på syrer
Hydrogenhalogenider
Alle hydrogenhalogenider er sure forbindelser, især når de opløses i vand:
-HF (flussyre).
-HCI (saltsyre).
-HBr (brombrintesyre).
-HI (iodsyre).
Oxosyrer
Oxosyrer er de protonerede former for oxoanioner:
HNO3 (salpetersyre).
HtoSW4 (svovlsyre).
H3PO4 (phosphorsyre).
HC14 (perchlorsyre).
Super syrer
Super syrer er blandingen af en stærk Bronsted syre og en stærk Lewis syre. Når de er blandet, danner de komplekse strukturer, hvor H ifølge visse undersøgelser+ "Spring" inde i dem.
Deres ætsende effekt er sådan, at de er milliarder gange stærkere end HtoSW4 koncentreret. De bruges til at knække store molekyler til stede i råolie, i mindre, forgrenede molekyler og med stor økonomisk værdi..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3F
-CF3SW3H
Organiske syrer
Organiske syrer er karakteriseret ved at have en eller flere carboxylgrupper (COOH), og blandt dem er:
-Citronsyre (findes i mange frugter)
-Æblesyre (fra grønne æbler)
-Eddikesyre (fra kommerciel eddike)
-Smørsyre (fra harskt smør)
-Vinsyre (fra vine)
-Og fedtsyrefamilien.
Referencer
- Torrens H. Hårde og bløde syrer og baser. [PDF]. Hentet fra: depa.fquim.unam.mx
- Helmenstine, Anne Marie, Ph.D. (3. maj 2018). Navne på 10 almindelige syrer. Gendannet fra: thoughtco.com
- Chempages Netorials. Syrer og baser: Molekylær struktur og adfærd. Hentet fra: chem.wisc.edu
- Deziel, Chris. (27. april 2018). Generelle egenskaber ved syrer og baser. Videnskabelig. Gendannet fra: sciencing.com
- Pittsburgh Supercomputing Center (PSC). (25. oktober 2000). Gendannet fra: psc.edu.



Endnu ingen kommentarer