
Natriumchlorit (NaClO2) struktur, egenskaber, anvendelser, risici

Det natriumchlorit er et uorganisk fast stof dannet af en natriumion Na+ og en chlorionion ClOto-. Dens kemiske formel er NaClOto. Det er et hvidt krystallinsk fast stof foruden at være et stærkt oxidationsmiddel. Derfor skal det håndteres med stor omhu..
Dens vigtigste anvendelse er som et desinfektionsmiddel til mange applikationer. Eliminerer mikrober på overflader såsom gulve, vægge og laboratorieudstyr på hospitaler og klinikker og i deres vandsystemer.

Også i landbrugs- og veterinærfaciliteter for at desinficere inkubatorer til fjerkrææg, til at kontrollere infektioner i yverne hos malkekøer, til at desinficere vandsystemer til dyr osv..
I fødevareindustrien bruges dens syrede vandige opløsninger til at vaske kød, kyllinger, frugt, grøntsager såvel som udstyret til sådanne faciliteter..
Chlordioxid kan fremstilles med natriumchlorit.to på stedet, der gør det muligt at fjerne mikrober, dårlig lugt og smag fra vandet, så det er behageligt og kan drikkes uden problemer.
Det bruges også til at blege papirmasse, vegetabilske tekstilfibre og olier, blandt andre applikationer..
NaClOto Fast stof skal håndteres med forsigtighed, da der kan komme eksplosioner i kontakt med visse materialer. Deres løsninger er lidt lettere at håndtere, men er meget oxiderende og ætsende..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Tæthed
- 3.5 Opløselighed
- 3.6 Andre egenskaber
- 4 risici
- 5 Opnåelse
- 6 anvendelser
- 6.1 Som et mikrobicid og desinfektionsmiddel i flere applikationer
- 6.2 Desinficering af drikkevand
- 6.3 Vedligeholdelse af kontaktlinser
- 6.4 I forskellige applikationer
- 7 Referencer
Struktur
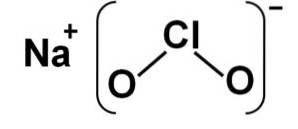
Natriumchlorit består af en natriumkation Na+ og en chloranion ClOto- derfor er de forbundet med en ionbinding.
Chloritanionen har et kloratom i en oxidationstilstand på +3 og to iltatomer med valens -2 hver. Af denne grund har chloritanionen en negativ ladning..
Det har også en vinkelformet struktur.
Nomenklatur
- Natriumchlorit
- Natriumchlorit
- Klorsyrenatriumsalt
Ejendomme
Fysisk tilstand
Fast hvid krystallinsk.
Molekylær vægt
90,44 g / mol.
Smeltepunkt
Det nedbrydes, når det smelter mellem 180 og 200 ºC.
Massefylde
2,468 g / cm3
Opløselighed
Opløselig i vand: 64 g / 100 g vand ved 17 ºC. Let opløselig i methanol.
Andre egenskaber
Det er let hygroskopisk.
Det er et stærkt oxidationsmiddel. Reagerer voldsomt med brændbare og reducerende materialer. Reagerer voldsomt med syrer og genererer klordioxid ClOto.
Dens alkaliske opløsninger (betyder i nærværelse af for eksempel NaOH) er ret stabile, mens der i et surt medium dannes klorsyre HClOto, som hurtigt bryder sammen:
4 HC1to → 2 ClOto↑ + ClO3- + Cl- + 2 timer+ + HtoELLER
Risici
Begge NaClOto Fast, da de vandige opløsninger er potentielt farlige og kræver stor forsigtighed og erfaring under håndtering og opbevaring..
NaClOto fast stof kan eksplodere ved kontakt med organiske stoffer, herunder handsker og tøj, materiale til spildkontrol såsom savsmuld og spild af bomuld samt olier og fedt.
Den faste form er derfor meget vanskelig at transportere, og det foretrækkes at anvende den i form af vandige opløsninger..
Disse løsninger er ekstremt ætsende. De bør fortrinsvis holdes ved en pH over 8, det vil sige en alkalisk pH.
NaClOto fremskynder forbrændingen af brændbare forbindelser eller materialer, indtil det kan danne eksplosive blandinger med dem.
Ved opvarmning udsender det giftige dampe af saltsyre HCI og natriumoxid NatoO. Langvarig udsættelse for varme eller ild kan eksplodere.
Opnåelse
Det fremstilles startende med den kemiske eller elektrokemiske reduktion af natriumchlorat NaClO3, i nærværelse af saltsyre HCI til fremstilling af chlordioxid ClOto.
Sidstnævnte omsættes med hydrogenperoxid HtoELLERto i vandig opløsning af natriumhydroxid NaOH og en opløsning af natriumchlorit NaClO opnåsto, som fordamper, og det faste stof krystalliserer.
Det kan også opnås ved at føre klordioxidgas ClOto ved en NaOH-opløsning.
2 ClOto + 2 NaOH → NaClOto + NaClO3 + HtoELLER
Ansøgninger
Som et mikrobicid og desinfektionsmiddel i flere applikationer
Det er en ingrediens i mange produkter, der bruges til at kontrollere bakterier, svampe og algeslam. De produkter, der indeholder det til dette formål, bruges i landbrug, handel, industri og boliger eller hjem..
Fungerer som desinfektionsmiddel til mange typer materialer og overflader.
I landbrug, fjerkræ og lignende industrier desinficeres hårde overflader, udstyr, faciliteter til inkubation af fugleæg, drivhuse til svampe, såsom svampe, og kølevand- og vandsystemer til fjerkræhuse..
Det har veterinær brug som et topisk desinfektionsmiddel til bekæmpelse af mastitis hos malkekvæg for at nedsænke dyrets brystvorter. Mastitis er en infektion i køernes yver.

Det bruges også i naturlige forskningsinstitutioner til at dekontaminere laboratorier.
Kommerciel, industriel og medicinsk anvendelse omfatter desinficering af ventilationssystemer, hårde overflader (såsom gulve, vægge, laboratorieudstyr) og vandsystemer..
På sundhedsfaciliteter som klinikker og hospitaler bruges det til at dekontaminere rum, korridorer, isoleringsområder og til sterilisering af materialer.
Det er også nyttigt til desinficering i virksomheder, hvor folk gennemgår sundhedsbehandlinger med vand eller spa.
I fødevareindustrien bruges det som en fumigant til at bevare mad.
Det bruges i form af forsuret natriumchlorit. Dette fremstilles ved at tilsætte fødevarekvalitet syre (for eksempel citronsyre, fosforsyre, æblesyre eller natriumsyresulfat) til en vandig opløsning af natriumchlorit..
Forsuret natriumchlorit har antimikrobielle egenskaber og bruges som en spray- eller vaske- eller blødgøringsopløsning til kylling, kød, grøntsager, frugt og skaldyr. Også i vand for at fryse kylling eller fjerkræ.
I hjem tillader det desinficering af hårde overflader, såsom gulve og badeværelser, varme- eller klimaanlæg og vandcirkulationssystemer i swimmingpoolen..


Det sælges også i små poser sammen med andre forbindelser for at frigive gas og kontrollere lugt i hjemmet..
At desinficere drikkevand
Det bruges til oprensning af drikkevand, fungerer som en oxidant, forbedrer smagen og lugten af drikkevand.
Natriumchlorit anvendes i vid udstrækning som en forløber til dannelsen af chlordioxid ClOto bruges til at behandle drikkevand til konsum, det vil sige at fjerne mikroorganismer, lugt og ubehagelig smag og kan drikkes.
At generere ClOto HCl kan bruges:
5 NaClOto + 4 HCI → 4 ClOto↑ + 5 NaCl + 2HtoELLER
ClOto det er et antimikrobielt middel med en høj oxiderende virkning og et bredt spektrum. Det vil sige, det virker mod et stort antal mikroorganismer.
Mikroorganismer inaktiveres, fordi ClOto det interfererer med vigtige enzymer af disse og med proteinerne i de cellulære membraner. Det har også den fordel, at det ikke producerer organiske klorforbindelser, som er giftige..
Der er natriumchlorit-tabletter til salg blandet med andre forbindelser, der opløses i vand og straks producerer ClOto på en kontrolleret måde, hvorved vandet desinficeres.

Hovedproblemet med behandling af vand for at fjerne smagsstoffer og lugte med ClOto er, at der kan dannes giftige chlorit- og chloratsalte under behandlingen.
Til pleje af kontaktlinser
NaClOto det er en komponent i de løsninger, der tjener til at desinficere kontaktlinser.
Der anvendes en kombination af NaClOto og spor (meget små mængder) af hydrogenperoxid HtoELLERto.
HtoELLERto stabiliserer ClOto der dannes, og kombinationen af begge er meget effektiv mod bakterier, svampe og gær. De resulterende produkter er natriumchlorid NaCl, vand og ilt, som er harmløse, hvilket betyder, at de ikke er skadelige for øjet.
Når linserne fjernes fra opløsningen, NaClOto Rester nedbrydes hurtigt til NaCl og Oto. Restperoxid irriterer ikke øjet. Derfor er disse løsninger meget sikre.

I forskellige applikationer
Natriumchlorit anvendes til fremstilling af chlordioxid ClOto til øjeblikkelig brug i et stort antal applikationer, hvoraf nogle blev diskuteret i tidligere afsnit.
Det bruges til at blege træmasse, tekstiler som bomuld, vegetabilske fibre, spiselige og uspiselige olier, fedt, lak, lak og voks.
Det er en komponent i øjendråber og nogle mundskyllevæsker..
Det bruges i læderforarbejdningsindustrien og i midler til galvanisering af metaller (metalcoating).
Referencer
- Williams, L. et al. (2019). Mikrobiologi, linsepleje og vedligeholdelse. I kontaktlinser (sjette udgave). Gendannet fra sciencedirect.com.
- OS. National Library of Medicine. (2019). Natriumchlorit. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Gray, N.F. (2014). Chlordioxid. Processteknologi. In Microbiology of Waterborne Diseases (Anden udgave). Gendannet fra sciencedirect.com.
- McKeen, L. (2012). Introduktion til madbestråling og medicinsk sterilisering. Chlordioxid. In The Effect of Sterilization on Plastic and Elastomers (Tredje udgave). Gendannet fra sciencedirect.com.
- Ortenberg, E. og Telsch, B. (2003). Smags- og lugtproblemer i drikkevand. I håndbog om vand- og spildevandsmikrobiologi. Gendannet fra sciencedirect.com.
- Karsa, D.R. (2007). Biocider. Chlordioxid. I håndbog til rengøring / dekontaminering af overflader. Gendannet fra sciencedirect.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte udgave. VCH Verlagsgesellschaft mbH.

Endnu ingen kommentarer