
Cobaltchlorid (CoCl2 (struktur, nomenklatur, egenskaber)

Det Cobaltchlorid eller cobalt (II) chlorid er et uorganisk fast stof dannet ved foreningen af cobaltmetal i dets oxidationstilstand +2 med chloridionen. Dens kemiske formel er CoClto.
CoClto Det er et krystallinsk fast stof, der i sin hydratiserede form er rødviolet i farven. Varm den forsigtigt op og fjern hydratiseringsvandet, gør det blåt. Disse farveændringer skyldes, at dit koordinerende nummer ændres.

Det er tidligere blevet brugt til behandling af visse typer anæmi, men det har vist sig at forårsage hjerteproblemer, døvhed, gastrointestinale problemer, dårlig skjoldbruskkirtelfunktion og åreforkalkning. Af disse grunde stoppede den ikke med at blive brugt og er stadig under undersøgelse..
CoClto det bruges til at fremskynde forskellige kemiske reaktioner. Dens hexahydratform i opløsning bruges som reference til visse kemiske analyser..
Det bruges til at efterligne hypoxi eller lav iltkoncentration i visse biologiske eller medicinsk-videnskabelige forskningserfaringer. Det er også blevet brugt til at forbedre nogle mekaniske egenskaber ved polymerer.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Opløselighed
- 3.7 Andre egenskaber
- 4 anvendelser
- 4.1 Behandling af specielle tilfælde af anæmi
- 4.2 Ved katalyse af kemiske reaktioner
- 4.3 Som standard i kemisk analyse
- 4.4 I iskæmiforskning
- 4.5 Som en model til at efterligne hypoxi i biologisk og medicinsk forskning
- 4.6 I forskning i brugen af vand som brintkilde
- 4.7 Forbedring af de mekaniske egenskaber ved polymerer
- 4.8 Administration skadelig eller dødelig for heste
- 5 Referencer
Struktur
Cobalt (II) chlorid består af et cobaltatom i dets oxidationstilstand +2 og to chloridanioner Cl-.
Elektronkonfigurationen af kationen Coto+ det er:
1sto, 2sto 2 s6, 3sto 3p6 3d7, 4s0,
fordi det har mistet de 2 elektroner fra 4s skal.
Den elektroniske struktur af anionen Cl- det er:
1sto, 2sto 2 s6, 3sto 3p6,
fordi det har fået en elektron i 3p-skallen.
Nomenklatur
-Cobalt (II) chlorid
-Kobaltchlorid
-Cobalt dichlorid
-Dichlorocobalt
-Kobolt mururer
-CoClto: vandfrit cobaltchlorid (uden hydratiseringsvand)
-CoClto•2HtoO: cobaltchloriddihydrat
-CoClto•6HtoO: cobaltchloridhexahydrat
Ejendomme
Fysisk tilstand
Krystallinsk fast stof, hvis farve afhænger af graden af hydrering.
CoClto vandfri: lyseblå

CoClto•2HtoO: violet
CoClto•6HtoO: rød-lilla eller lyserød

Molekylær vægt
CoClto: 129,84 g / mol
CoClto•2HtoO: 165,87 g / mol
CoClto•6HtoO: 237,93 g / mol
Smeltepunkt
CoClto: 735 ºC
CoClto•6HtoO: 86 ºC
Kogepunkt
CoClto: 1053 ºC
Massefylde
CoClto: 3,356 g / cm3
CoClto•2HtoO: 2,447 g / cm3
CoClto•6HtoO: 1.924 g / cm3
Opløselighed
CoClto: 45 g / 100 ml vand
CoClto•2HtoEller: 76 g / 100 ml vand
CoClto•6HtoEller: 93 g / 100 ml vand
Andre egenskaber
Cobalt (II) -chloridhexahydrat er lyserødt, men når det er let opvarmet, bliver det blåt, da det mister vand. Hvis CoClto vandfri efterlades i en fugtig atmosfære, den bliver lyserød.
Farven på den cobaltøse ion afhænger af koordinationsnummeret, det vil sige på grupperne, der er knyttet til Co-ionen.to+. Et koordinationstal på 6 svarer til lyserøde forbindelser, og et koordinationstal på 4 resulterer i blå forbindelser..
Når CoClto findes i vandig opløsning, opstår følgende ligevægt:
Co (HtoELLER)6++ + 4 Cl- ⇔ CoCl4- + 6 timertoELLER
Når ligevægt skifter mod Co (HtoELLER)6++ opløsningen er rød, mens den bevæger sig mod CoCl4- løsningen er blå.
Ansøgninger
Behandling af specielle tilfælde af anæmi
Cobaltchlorid blev meget brugt siden 1930'erne til behandling af visse typer anæmi, både i Europa og i USA..
Dens orale indgivelse favoriserer en stigning i hæmoglobin, erythrocytantal og hæmatokrit. Responsen er proportional med den anvendte dosis. Dette skyldes, at det udøver en stimulerende virkning på knoglemarven..
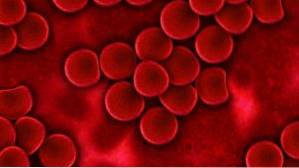
Imidlertid blev brugen afbrudt på grund af bivirkninger som gastrointestinalt ubehag, kardiomyopatier, nervedøvhed og unormal skjoldbruskkirtelfunktion..
På trods af disse ulemper blev det med succes testet i 1975 hos patienter med nyresvigt, hvis anæmi er forårsaget af gentaget blodtab på grund af dialyse..
Det blev fundet, at hæmatokrit og røde blodlegemer steg hos disse patienter, hvilket indikerer stimulering af erythropoies eller dannelse af røde blodlegemer..
Af denne grund blev cobaltchlorid anset for at være af værdi i hæmodialysepatienter, på hvem andre måder at lindre anæmi har mislykket..
Imidlertid blev det senere observeret, at høje niveauer af Coto+ i blod var relateret til aterosklerose, så der udføres i øjeblikket flere undersøgelser for at bestemme dets potentielle fordele eller skade for denne type patienter.
I katalyse af kemiske reaktioner
Cobaltchlorid kan anvendes i accelerationen af visse kemiske reaktioner.
For eksempel ved forestring af umættede forbindelser med høj molekylvægt kan anvendelsen af CoClto som en katalysator fører det til opnåelse af det ønskede produkt uden dannelse af sikkerhedsderivater.
Forøgelse af CoCl-koncentrationento og temperaturen øger reaktionshastigheden.
Som standard i kemisk analyse
CoClto•6HtoEller det bruges som en standard- eller farvehenvisning i nogle analysemetoder fra American Public Health Association eller APHA. American Public Health Association).

I iskæmiforskning
Iskæmi er faldet i blodgennemstrømningen i en del af kroppen, og midler undersøges løbende for at undgå det eller forhindre dets konsekvenser.
CoCl er fundetto kan inducere apoptose eller celledød af kræftmodelceller.
CoClto det udløser produktionen af reaktive iltarter i sådanne kræftmodelceller, hvilket fører til deres død via apoptose. Siges at fremkalde et hypoxi-efterlignende svar.
Dette resultat indikerer, at CoClto kan hjælpe med at undersøge den molekylære mekanisme i hypoxiassocieret celledød og at finde midler mod iskæmi.
Som en model til at efterligne hypoxi i biologisk og medicinsk forskning
Hypoxi er det fald i tilgængeligt ilt, der er nødvendigt for cellens funktion. CoClto er en af de forbindelser, der anvendes i medicinsk-videnskabelig og biologisk forskning til at inducere kemisk hypoxi.
Virkningsmekanismen for CoClto i celler giver forskeren længere tid til at manipulere og analysere deres prøver under hypoxiske forhold.
Dens anvendelse betragtes som en pålidelig metode, da den tillader eksperimenter under lave iltforhold uden brug af specielle kameraer..
Fortolkningen af de opnåede resultater skal dog nøje gennemgås, da forskeren skal sikre, at cobalt ikke har andre virkninger på funktionen af cellerne under undersøgelse bortset fra at efterligne hypoxi..
I forskning i brugen af vand som kilde til brint
Cobaltchlorid er blevet undersøgt som en katalysator i undersøgelsen af at opnå brint fra vand ved hjælp af solenergi.
Co-ionento+ kan fungere som en homogen katalysator under den fotokemiske oxidation af vand under sure betingelser (tilstedeværelse af syre HCI og pH 3) for at undgå udfældning.
Denne type undersøgelser kaster lys og hjælper med at søge efter ren energi og bæredygtig solenergi..
For at forbedre polymerers mekaniske egenskaber
Nogle forskere indarbejdede CoClto til acrylonitril-butadien-styren-polymerblandinger eller ABS. Akrylnitril-butadien-styren), med nitril-butadiengummi eller NBR (akronym på engelsk Nitrilbutadiengummi).
CoCl blev inkorporeretto til ABS-NBR-blandingen, og det hele blev varmekomprimeret. Resultaterne indikerer, at NBR var jævnt spredt i ABS, og at CoClto har tendens til at blive distribueret i NBR-fasen.
Koordineringsreaktionen mellem kationerne Coto+'og -CN-grupper har en positiv indvirkning på mekaniske egenskaber. Ved at øge CoCl-indholdetto øger trækstyrken og letter bøjningen.
Imidlertid blev der observeret et fald i termisk stabilitet og problemer med absorptionen af vand fra CoCl.to, Derfor vil denne type blanding fortsat blive undersøgt..
Skadelig eller dødelig indgift til heste
CoClto er blevet brugt i meget små mængder i hestefoder.
Cobalt er et vigtigt element (i spor) til hestens ernæring, da det bruges af bakterier i deres tarmkanaler til at syntetisere vitamin B12 (cobalamin)..
Nylige undersøgelser (2019) viser imidlertid, at kobolttilskud i hestefoder hverken er nyttigt eller nødvendigt, og at det potentielt kan være dødeligt for disse dyr.

Referencer
- Wenzel, R.G. et al. (2019). Cobaltakkumulering hos heste efter gentagen indgivelse af cobaltchlorid. Australian Veterinary Journal 2019, Early View, 16. august 2019. Gendannet fra onlinelibrary.wiley.com.
- Muñoz-Sánchez, J. og Chánez-Cárdenas, M. (2018). Anvendelsen af cobaltchlorid som en kemisk hypoxi-model. Journal of Applied Toxicology 2018, 39 (4): 1-15. Gendannet fra onlinelibrary.wiley.com.
- Liu, H. et al. (2015). Homogen fotokemisk vandoxidation med koboltchlorid i sure medier. ACS Catalists 2015, 5, 4994-4999. Gendannet fra pubs.acs.org.
- Shao, C. et al. (2018). Acrylonitril-butadien-styren / nitril-butadien-gummiblandinger forbedret med vandfrit cobaltchlorid. Journal of Applied Polymer Science 2018, bind 135, udgave 41. Gendannet fra onlinelibrary.wiley.com.
- Zou, W. et al. (2001). Cobaltchlorid inducerer PC12-celler Apoptose gennem reaktive iltarter ad ledsaget af AP-1-aktivering. Journal of Neuroscience Research 2001, 64 (6): 646-653. Gendannet fra onlinelibrary.wiley.com.
- Urteaga, L. et al. (1994). Kinetisk undersøgelse af syntesen af n-Octyloctanoat ved anvendelse af koboltchlorid som katalysator. Chem. Eng. Technol. 17 (1994) 210-215. Gendannet fra onlinelibrary.wiley.com.
- Murdock, H.R.Jr. (1959). Undersøgelser af farmakologi af koboltchlorid. Journal of the American Pharmaceutical Association 1959, bind 48, udgave 3, side 140-142. Gendannet fra onlinelibrary.wiley.com.
- Bowie, E.A. og Hurley, P.J. (1975). Cobaltchlorid til behandling af ildfast anæmi hos patienter, der gennemgår langvarig hæmodialyse. Australian and New Zealand Journal of Medicine 1975, bind 5, udgave 4, s. 306-314. Gendannet fra onlinelibrary.wiley.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Dean, J.A. (redaktør) (1973). Lange's Chembook. Ellevte udgave. McGraw-Hill Book Company.
- Babor, J.A. og Ibarz, J. (1965). Moderne generel kemi. 7. udgave. Redaktionel Marín, S.A.

Endnu ingen kommentarer