
Lithiumchlorid (LiCl) egenskaber, risici og anvendelser
Det Lithiumchlorid Det er en kemisk forbindelse med formlen LiCl, der kan fremstilles ved antændelse af lithium og chlor, selvom det er vanskeligt, fordi reaktionen er voldsom. På denne måde produceres den vandfri form (uden vand). Lithiumchlorid kan også ekstraheres fra andre alkalimetalchlorider med amylalkohol..
Indtil 1990'erne var metal- og lithiummarkedet domineret af amerikansk produktion fra mineralforekomster. I begyndelsen af det 21. århundrede stammer det meste af produktionen imidlertid fra ikke-amerikanske kilder, hvor Australien, Chile og Portugal er de vigtigste leverandører i verden..
Som en nysgerrighed er det værd at bemærke, at selvom Bolivia har halvdelen af verdens lithiumforekomster, er det ikke en stor producent.
Den vigtigste kommercielle form er lithiumcarbonat, LitoCO3, fremstillet af mineraler eller saltlage ved flere forskellige processer.
Tilsætningen af saltsyre (HCI) producerer lithiumchlorid. Med denne metode produceres den hydratiserede forbindelse (vand bundet til molekylet). Den hydratiserede form kan tørres til den vandfri form ved opvarmning med hydrogenchloridgas..
Fysiske og kemiske egenskaber af lithiumchlorid
Lithiumchlorid er et hvidt fast stof uden særlig aroma og en salt smag (National Center for Biotechnology Information, 2005). Dens udseende er vist i figur 2.

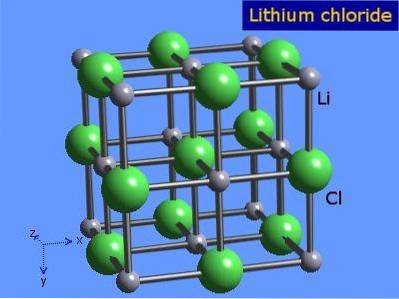
Lithiumchlorid er yderst hygroskopiske krystaller med oktaedrisk geometri svarende til natriumchlorid. Dens krystallinske struktur er vist i figur 3 (Winter, S.F.).
Dens molekylvægt er 42,39 g / mol, dens densitet er 2,068 g / ml, og dens smelte- og kogepunkter er henholdsvis 605 ° C og 1360 ° C..
Forbindelsen er meget opløselig i vand, alkohol, ether, pyridin og nitrobenzen (Royal Society of Chemistry, 2015).
Lithiumchlorid har svag oxiderende eller reducerende effekt. Redoxreaktioner kan dog stadig forekomme. Lithiumchloridopløsninger er generelt hverken stærkt sure eller stærkt basiske..
Da det er ekstremt hygroskopisk, kan lithiumchlorid også absorbere op til fire ækvivalenter ammoniak pr. Mol. Vandige lithiumchloridopløsninger kan korrodere metaller (LITHIUM CHLORIDE, S.F.).
Reaktivitet og farer
Lithiumchlorid er en stabil forbindelse, der er uforenelig med stærke oxidationsmidler, stærke syrer, bromtrichlorid, bromtrifluorid.
Det er ikke giftigt ved indtagelse, men på grund af dets ætsende natur kan det være irriterende i kontakt med hud og øjne, det kan også irritere næsepassagerne (National Institute for Occupational Safety and Health, 2015).
I tilfælde af kontakt med øjnene skal du kontrollere, om du har kontaktlinser, og fjerne dem med det samme..
Øjne skal skylles med rindende vand i mindst 15 minutter, så øjenlågene holdes åbne. Koldt vand kan bruges. Øjen salve bør ikke bruges.
Hvis kemikaliet kommer i kontakt med tøj, skal du fjerne det så hurtigt som muligt og beskytte dine egne hænder og krop.
Anbring offeret under et sikkerhedsbrusebad. Hvis kemikaliet akkumuleres på offerets udsatte hud, såsom hænder, vaskes den forurenede hud forsigtigt og omhyggeligt med rindende vand og ikke-slibende sæbe..
Koldt vand kan bruges. Søg lægehjælp, hvis irritationen vedvarer. Vask det forurenede tøj, inden det bruges igen.
I tilfælde af indånding skal offeret få lov til at hvile i et godt ventileret område. Hvis inhalationen er svær, skal offeret evakueres til et sikkert område hurtigst muligt..
Løsn stramt tøj såsom en skjortekrave, bælte eller slips. Hvis offeret har svært ved at trække vejret, skal der gives ilt.
Hvis offeret ikke trækker vejret, udføres genoplivning fra mund til mund. Husk altid, at det kan være farligt for den person, der yder hjælp til at give genoplivning fra mund til mund, når det indåndede materiale er giftigt, smitsomt eller ætsende..
I alle tilfælde bør øjeblikkelig lægehjælp søges (Sikkerhedsdatablad Lithiumchlorid, 2013).
Ansøgninger
Lithiumchlorid er den forbindelse, der anvendes til fremstilling af lithiummetal ved elektrolyse. Lithiummetal fremstilles ved elektrolyse af en smeltet blanding af lithium og kaliumchlorider.
Blandingens nedre smeltepunkt (400-420 ° C eller 750-790 ° F) sammenlignet med rent lithiumchlorid (610 ° C eller 1130 ° F) muliggør drift ved lavere temperatur i elektrolysen.
Da den spænding, hvormed lithiumchloridnedbrydning finder sted, er lavere end for kaliumchlorid, deponeres lithium på et renhedsniveau, der er større end 97 procent (Dye, 2017).
Flydende lithiumchlorid fungerer som et tørremiddel, der kan reducere fugtighedsniveauerne i den omgivende luft med op til 15 procent.
Flydende tørremiddel, der kombinerer lithiumchlorid og calciumchlorid, skaber et stof, der er billigere end lithiumchlorid, men mere stabilt end calciumchlorid..
Lithiumchlorid afkøler luften hurtigt, fordi kemikaliet indeholder en enorm mængde vand til sin vægt som et fast stof. Stoffet tørrer også store mængder industrigasser.
Lithiumchlorid er et rødt farvestof i pyrotekniske udstillinger som fyrværkeri. Lithiumchlorid eller ethvert vandopløseligt lithiumbaseret salt brænder rødt, når det er tændt.
Særlige pyrotekniske virkninger kan antændes ved at blande ioniske salte med brandfarlige væsker såsom methylalkohol..
I 1940'erne fungerede lithiumchlorid som erstatning for bordsalt, men nogle patienter døde af toksiske niveauer af lithium..
Forbindelsen har farmakologiske anvendelser som antimaniakker, som er midler anvendt til behandling af bipolare lidelser eller mani associeret med andre affektive lidelser..
Den menneskelige krop indeholder normalt ca. 7 milligram lithium til enhver tid..
Lithium forekommer naturligt i planter, da organismer bruger stoffet til at stimulere vækst.
Referencer
- Dye, J. L. (2017, 23. januar). Lithium (Li). Gendannet fra britannica: britannica.com.
- EMBL-EBI. (2009, 23. november). lithiumchlorid. Gendannet fra ChEBI: ebi.ac.uk.
- LITIUMCHLORID. (S.F.). Gendannet fra CAMEO: cameochemicals.noaa.gov.
- Sikkerhedsdatablad Lithiumchlorid. (2013, 21. maj). Gendannet fra sciencelab.com.
- National Center for Biotechnology Information… (2005, 26. marts). PubChem Compound Database; CID = 433294. Hentet fra PubChem.
- National Institute for Occupational Safety and Health. (2015, 22. juli). LITIUMCHLORID. Gendannet fra cdc.gov.
- Winter, M. (S.F.). Lithium: lithiumchlorid. Gendannet fra webelementer.



Endnu ingen kommentarer