
Elektronisk kernekonfigurationskonstruktion, eksempler
Det kernelektronkonfiguration eller kompakt er en, hvis kvantebeskrivelser for antallet af elektroner og deres energiniveau er forkortet med ædelgassymboler i parentes. Det er meget nyttigt, når du skriver elektroniske konfigurationer til et bestemt element, da det er enkelt og hurtigt.
Ordet 'kerne' henviser normalt til de indre elektroniske skaller i et atom; det vil sige dem, hvor deres elektroner ikke har valens og derfor ikke deltager i den kemiske binding, skønt de definerer elementets egenskaber. Metaforisk set vil kernen være det indre af løg med dets lag sammensat af en række orbitaler, der øges i energi.
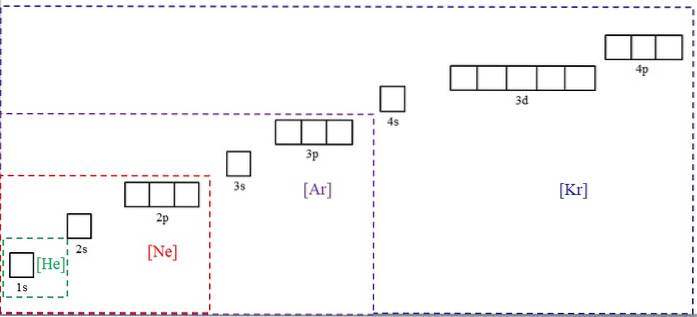
Ovenstående billede viser de kemiske symboler for fire af ædelgasserne i parentes og med forskellige farver: [He] (grøn), [Ne] (rød), [Ar] (lilla) og [Kr] (blå).
Hver af dens stiplede rammer indeholder felter, der repræsenterer orbitalerne. Jo større de er, jo større antal elektroner indeholder de; hvilket igen vil betyde, at de elektroniske konfigurationer af flere elementer kan forenkles med disse symboler. Dette sparer tid og energi ved at skrive alle notationerne.
Artikelindeks
- 1 Byg rækkefølge
- 2 Forkortelse for elektronkonfiguration
- 3 eksempler
- 3.1 Generelt
- 3.2 Oxygen
- 3.3 Kalium
- 3.4 Indisk
- 3.5 Wolfram
- 4 Referencer
Byg rækkefølge
Før du bruger elektroniske kernekonfigurationer, er det en god ide at gennemgå den rigtige rækkefølge for at opbygge eller skrive disse konfigurationer. Dette styres i henhold til reglen om diagonaler eller Moeller-diagram (kaldes i nogle dele regnmetoden). Med dette diagram ved hånden er kvantennotationerne som følger:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Denne række af kvantebeskrivelser ser anstrengende ud; og det ville være endnu mere, hvis det skulle skrives hver gang elektronkonfigurationen af et hvilket som helst element fundet i periode 5 og fremover ville blive repræsenteret. Bemærk også, at strengen er tom for elektroner; der er ingen tal i de øverste højre vinkler (1sto2sto2 s6...).
Det skal huskes, at orbitalerne s kan "huse" to elektroner (nsto). Orbitaler s der er i alt tre (se de tre felter ovenfor), så de kan rumme seks elektroner (np6). Og endelig orbitalerne d der er fem, og F syv med i alt ti (nd10) og fjorten (nf14) elektroner.
Forkortelse for elektronkonfiguration
Når det er sagt ovenfor, fortsætter vi med at udfylde den foregående række af kvantebeskrivelser med elektroner:
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Hvor mange elektroner er der i alt? 118. Og hvilket element svarer et så stort antal elektroner til i dets atom? Til ædelgasoganesonen Og.
Antag, at der er et element med et kvantetal Z lig med 119. Derefter ville dets valenselektronkonfiguration være 8s1; men hvad ville dens komplette elektroniske konfiguration være?
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6 8s1
Og hvad ville din elektroniske kernekonfiguration være, den kompakte? Er:
[Og] 8s1
Bemærk den åbenlyse forenkling eller forkortelse. I symbolet [Og] tælles alle 118 elektroner, der er skrevet ovenfor, så dette usikre element har 119 elektroner, hvoraf kun den ene har valens (det ville være placeret under francium i det periodiske system).
Eksempler
generel
Antag nu, at du gradvist vil gøre forkortelsen:
[Han] 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Bemærk, at 1sto det blev erstattet af [Han]. Den næste ædelgas er neon, som har 10 elektroner. Ved at vide dette fortsætter forkortelsen:
[Ne] 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Derefter følger argon med 18 elektroner:
[Ar] 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Fordi den næste ædelgas er krypton, fremføres forkortelsen med yderligere 36 elektroner:
[Kr] 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Xenon har 54 elektroner, og derfor flytter vi forkortelsen til 5p-orbitalen:
[Xe] 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Nu vil du have bemærket, at elektronkonfigurationen altid er forkortet til np-orbitalen; de ædle gasser har disse orbitaler fyldt med elektroner. Og endelig følger radon med 86 elektroner, så vi forkorter til 6p-orbitalen:
[Rn] 7sto 5f14 6d10 7p6
Ilt
Oxygen har otte elektroner, hvis komplette elektroniske konfiguration er:
1sto2sto2 s4
Den eneste forkortelse, vi kan bruge, er [He] i 1sto. Din elektroniske kernekonfiguration bliver således:
[Han] 2sto2 s4
Kalium
Kalium har nitten elektroner, hvis komplette elektroniske konfiguration er:
1sto 2sto 2 s6 3sto 3p6 4s1
Bemærk, at vi kan bruge symbolet [He] til at forkorte denne konfiguration; samt [Ne] og [Ar]. Sidstnævnte er den, der bruges, fordi argon er den ædle gas, der kommer tættest på kalium. Så din kernelektronkonfiguration ser ud som:
[Ar] 4s1
Indisk
Indium har niogfyrre elektroner, hvis komplette elektroniske konfiguration er:
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s1
Da krypton er den nærmeste ædelgas, der går forud for indium, bruges symbolet [Kr] til forkortelsen, og vi har dens kernelektronkonfiguration:
[Kr] 5sto 4d10 5 s1
Selvom 4d-orbitalerne ikke formelt hører til indium-kernen, er deres elektroner ikke involveret (i det mindste under normale forhold) i dens metalliske binding, men snarere de fra 5s og 5p orbitaler..
Wolfram
Wolfram (eller wolfram) har 74 elektroner, og dens komplette elektronkonfiguration er:
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d4
Igen ser vi efter den nærmeste ædelgas, der går forud for den. I dit tilfælde svarer det til xenon, som har sine fulde 5p orbitaler. Så vi udskifter strengen af kvantebeskrivelser med symbolet [Xe], og vi får endelig dens kernelektronkonfiguration:
[Xe] 6sto 4f14 5 d4
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Pat Thayer. (2016). Elektronkonfigurationsdiagrammer. Gendannet fra: chemistryapp.org
- Helmenstine, Anne Marie, Ph.D. (5. december 2018). Definition af ædelgaskerne. Gendannet fra: thoughtco.com/
- Wikipedia. (2019). Elektronisk konfiguration. Gendannet fra: es.wikipedia.org

Endnu ingen kommentarer