
Sodium dichromate (Na2Cr2O7) egenskaber, produktion, anvendelser

Det natriumdichromat det er en uorganisk forbindelse med formlen Na2Cr207. Det er en af mange hexavalente chromforbindelser (Cr VI). Dens struktur er illustreret i figur 1, skønt saltet normalt håndteres i sin dihydratiserede form, hvis formel vil være Na2Cr2O7 · H2O.
Den har to ionbindinger mellem natriummolekyler og negativt ladet ilt. Krommalm ekstraheres fra natriumdichromat. Millioner kg natriumdichromat produceres årligt.
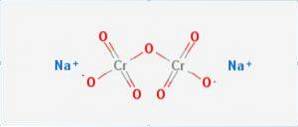
Kina er den største producent af natriumdichromat, men kinesiske kemiske anlæg har en relativt lav produktion, mindre end 50.000 tons om året, sammenlignet med det kasakhiske anlæg, der producerer mere end 100.000 tons om året..
Planter i Rusland, USA og Det Forenede Kongerige har en mellemproduktion mellem 50.000 og 100.000 tons om året (Kogel, 2006).
Med hensyn til reaktivitet og udseende har natriumdichromat lignende egenskaber som kaliumdichromat, men natriumsaltet er mere opløseligt i vand og har en lavere ækvivalentvægt end kaliumsaltet..
Natriumdichromat producerer giftige chromdampe, når de opvarmes. Det er et stærkt oxidationsmiddel og er meget ætsende.
Denne forbindelse kan findes i forurenede drikkevandskilder fra forskellige industrielle processer, såsom galvanisering eller galvanisering, lædergarvning og tekstilfremstilling..
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Produktionsmetoder
- 3 Reaktivitet og farer
- 4 Anvendelser og applikationer
- 5 Biokemi
- 6 Referencer
Fysiske og kemiske egenskaber
Natriumdichromat består af krystaller med en monoklinisk struktur, der har rød-orange farve i vandfri og lugtfri form. Dens molekylvægt er 261,97 g / mol i sin vandfri form og 298,00 g / mol i sin dihydratform..
Det har et smeltepunkt på 356,7 grader Celsius, et kogepunkt på 400 grader Celsius, hvor det nedbrydes. Det har en densitet på 2,52 g / ml.

Udseendet af natriumdichromat er vist i figur 2. Dens opløselighed i vand er 187 g pr. 100 gram ved 25 grader Celsius, og dets opløselighed i ethanol er 513,2 gram pr. Liter ved 19,4 grader Celsius (National Center for Biotechnology Information, n.d.).
Det betragtes som en stabil forbindelse, hvis den opbevares under anbefalede forhold, og den ikke er brandfarlig. Da det er et stærkt oxidationsmiddel, er det ætsende, og i opløsning er det syre med evnen til at sænke pH til 4 i en 1% w / v opløsning..
Produktionsmetoder
Natriumchromat kan omdannes til dichromat gennem en kontinuerlig proces, der beskæftiger sig med svovlsyre, kuldioxid eller en kombination af disse to..
Fordampningen af natriumdichromatluden forårsager udfældning af natriumsulfat og / eller natriumbicarbonat, og disse forbindelser fjernes inden den endelige krystallisation af natriumdichromat..
Sodiumdichromat kan fremstilles i en tretrins proces:
- Alkaliske stege chromit oxidationsbetingelser
- Udvaskning. Ekstraktion af opløseligt stof fra en blanding ved hjælp af et flydende opløsningsmiddel
- Omdannelse af natriummonochromat til natriumdichromat ved hjælp af en syre.
Vandfrit natriumdichromat kan fremstilles ved at smelte natriumdichromatdihydrat, krystallisere vandige dichromatopløsninger over 86 ° C eller tørre natriumdichromatopløsninger i spraytørrere..
Sodiumdichromatopløsninger ved 69 og 70% w / v anvendes som en bekvem og omkostningseffektiv metode til forsendelse af mængder, hvilket undgår behovet for manuel håndtering eller krystalopløsning..
Reaktivitet og farer
Det er et stærkt oxidationsmiddel. Uforenelig med stærke syrer. Kontakt med brændbare materialer kan forårsage brand. Giftige chromoxidgasser kan dannes i nærvær af varme eller ild.
Den velkendte "kromsyreblanding" af dichromat og svovlsyre med organiske rester giver anledning til en voldsom exoterm reaktion. Denne blanding i kombination med acetonerester fører også til en voldsom reaktion..
Kombinationen af dichromat og svovlsyre med alkoholer, ethanol og 2-propanol giver anledning til en voldsom exoterm reaktion. På grund af forekomsten af mange hændelser, der involverer blanding af dichromat-svovlsyre med oxiderbare organiske materialer, er det sandsynligvis bedst at undgå sådanne interaktioner..
Kombinationen af dichromat med hydrazin er eksplosiv, reaktionen af dichromat kan forventes at være kraftig med aminer generelt. Tilsætningen af det dehydratiserede dichromatsalt til eddikesyreanhydrid fører til en endelig eksplosiv eksoterm reaktion..
Bor, silicium og dichromater danner pyrotekniske blandinger. En blanding af eddikesyre, 2-methyl-2-pentenal og dichromat fører til en voldsom reaktion (kemisk datablad Sodium Dichromate., 2016).
Indånding af støv eller tåge forårsager irritation af luftvejene, der undertiden ligner astma. Septalperforering kan forekomme. Det betragtes som gift.
Indtagelse forårsager opkastning, diarré og meget usædvanligt komplikationer i mave og nyre. Kontakt med øjne eller hud forårsager lokal irritation. Gentagen eksponering af huden forårsager dermatitis.
Natriumdichromat er kræftfremkaldende for mennesker. Der er tegn på, at hexavalent chrom eller Cr (VI) forbindelser kan forårsage lungekræft hos mennesker. Sodiumdichromat har vist sig at forårsage lungekræft hos dyr.
Selvom natriumdichromat ikke er blevet identificeret som en teratogen eller reproduktiv risikoforbindelse, er det kendt, at hexavalent chrom- eller Cr (VI) -forbindelser er teratogener og forårsager reproduktiv skade såsom nedsættelse af fertilitet og interferens med menstruationscyklusser..
Natriumdichromat kan forårsage lever- og nyreskader, så det skal håndteres med ekstrem forsigtighed (New Jersey Department of Health, 2009).
I tilfælde af indtagelse skal offeret drikke vand eller mælk; fremkald aldrig opkastning. I tilfælde af kontakt med huden eller øjnene skal det behandles som syreforbrændinger; skyl øjnene med vand i mindst 15 minutter.
Eksterne læsioner kan gnides med en 2% natriumthiosulfatopløsning. I alle tilfælde bør en læge konsulteres.
Anvendelser og applikationer
Bortset fra dets betydning i fremstillingen af andre chromkemikalier har natriumdichromat også mange direkte anvendelser som ingrediens i produktionen af:
- Metallic finish: hjælper modstandsdygtig over for korrosion og rene metaloverflader, og favoriserer også malingsadhæsion.
- Organiske produkter: anvendes som oxidationsmidler til fremstilling af produkter såsom vitamin K og voks.
- Pigmenter: anvendes til fremstilling af uorganiske kromatpigmenter, hvor det producerer en række farver, der er stabile over for lys. Nogle kvaliteter af kromat anvendes også som korrosionsinhibitorer i undercoats og primere..
- Keramik: bruges til fremstilling af farvet glas og keramisk glasur.
- Tekstil: bruges som et mordant til syrefarvestoffer for at forbedre deres hurtige farveegenskaber.
- Produktion af kromsulfat.
(Sodium dichromate. Byggesten til stort set alle andre chromforbindelser., 2010-2012)
Sodium Dichromate Dihydrate, ideel til brug under forskellige forhold, herunder applikationer ved høje temperaturer, såsom keramisk glasur og farvet glas.
Chromoxid, der er hårdere end andre metaloxider, såsom titanium eller jern, er ideel til miljøer, hvor temperaturen og procesforholdene er aggressive.
Dette stof bruges hovedsageligt til at producere andre chromforbindelser, men det bruges også i bentonitslam, der anvendes i olieproduktion, i træbeskyttelsesmidler, i produktionen af organiske kemikalier og som en korrosionshæmmer..
Når det blandes med kaliumaluminiumdichromat under anvendelse af den aluminium-termiske proces, producerer chromoxid metallisk chrom med høj renhed. Dette er en vigtig ingrediens i produktionen af de højtydende superlegeringer, der anvendes i luftfartsindustrien..
I organisk syntese anvendes natriumdichromat som et oxidationsmiddel i oxidreduktionsreaktioner i nærvær af svovlsyre..
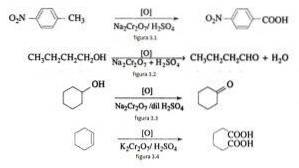
For eksempel oxidation af p nitrotoluen til dannelse af p nitrobenzoesyre, i oxidationen af n-butanol til dannelse af n-butaldehyd, i dannelsen af cyclohexanon fra cyclohexanol og dannelsen af adipinsyre som illustreret i figur 3.1, 3.2, 3.3 og 3.4 henholdsvis (VK Ahluwalia, 2004).
Biokemi
Intratrakeal instillation af natriumdichromat (CrVI) og chromacetathydroxid (CrIII) hos hanrotter resulterede i øgede koncentrationer af chrom i fuldblod, plasma og urin i op til 72 timer efter eksponering; Topkoncentrationer blev nået 6 timer efter eksponering..
Forholdet mellem fuldblods krom og plasmakromkoncentrationer var signifikant forskellig for Cr (VI) og Cr (III) behandlinger. Derfor bør blodchrom- og plasmakromtest anvendes til vurdering af chromeksponering..
Krom blev også påvist i perifere lymfocytter. Cr (VI), men ikke Cr (III) akkumuleret signifikant i lymfocytter efter behandling. Disse celler har potentialet til at blive brugt som biomarkører i vurderingen af eksponering for chromforbindelser (Hooth, 2008).
Referencer
- Kemisk datablad Sodium Dichromate. (2016). Hentet fra cameokemikalier: cameochemicals.noaa.
- Hooth, M. J. (2008). Teknisk rapport om toksikologi og kræftfremkaldende studier af natriumdichromat dihydreret. National Institute of Health USA.
- Kogel, J. E. (2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses Seventh Edition. littleton colorado: samfund af minedrift, metallurgyc og exploration inc.
- National Center for Biotechnology Information. (s.f.). PubChem Compound Database; CID = 25408. Hentet fra pubchem.com: pubchem.ncbi.nlm.nih.gov.
- New Jersey Department of Health. (2009, november). farligt stof faktaark natriumdichromat. Hentet fra nj.gov: nj.gov.
- Natriumdichromat. Byggesten til stort set alle andre chromforbindelser. (2010-2012). Hentet fra elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Omfattende praktisk organisk kemi: præparater og kvantitative analyser. Delhi: Universitetspresse (Indien).


Endnu ingen kommentarer