
Elektrolyse af vandprocedure, teknikker, hvad det er beregnet til
Det elektrolyse af vand Det er nedbrydningen af vand i dets elementære komponenter ved anvendelse af en elektrisk strøm. Når du fortsætter, brint og molekylært ilt, Hto migto. Disse to overflader er bedre kendt under navnet elektroder..
Teoretisk set er volumenet af Hto dannet skal være dobbelt så stort som Oto. Hvorfor? Fordi vandmolekylet har et H / O-forhold lig med 2, det vil sige to H for hvert ilt. Dette forhold bekræftes direkte med dets kemiske formel, HtoO. Imidlertid påvirker mange eksperimentelle faktorer de opnåede volumener.

Hvis elektrolysen udføres inde i rør nedsænket i vand (øverste billede) svarer den nedre søjle med vand til brint, da der er en større mængde gas, der udøver tryk på overfladen af væsken. Boblerne omgiver elektroderne og ender med at stige efter at have overvundet vandets damptryk.
Bemærk, at rørene er adskilt fra hinanden på en sådan måde, at der er lav gasvandring fra den ene elektrode til den anden. I lave skalaer udgør dette ikke en overhængende risiko; men på industrielle skalaer er den gasformige blanding af Hto migto det er meget farligt og eksplosivt.
Af denne grund er de elektrokemiske celler, hvor elektrolysen af vand udføres, meget dyre; De har brug for et design og elementer, der sikrer, at gasser aldrig blandes, en omkostningseffektiv strømforsyning, høje koncentrationer af elektrolytter, specielle elektroder (elektrokatalysatorer) og mekanismer til lagring af Hto produceret.
Elektrokatalysatorer repræsenterer friktion og på samme tid vinger til rentabilitet ved elektrolyse af vand. Nogle består af ædle metaloxider, såsom platin og iridium, hvis priser er meget høje. Det er på dette tidspunkt især hvor forskere går sammen om at designe effektive, stabile og billige elektroder..
Årsagen til disse bestræbelser er at fremskynde dannelsen af Oto, som forekommer ved lavere hastigheder sammenlignet med Hto. Dette bremser af elektroden, hvor O dannesto det bringer som en generel konsekvens anvendelse af et potentiale, der er meget større end nødvendigt (overpotentiale); hvad er det samme, til en lavere præstation og højere udgifter.
Artikelindeks
- 1 Elektrolysereaktion
- 1.1 Halvcellereaktioner
- 2 Fremgangsmåde
- 3 teknikker
- 3.1 Elektrolyse med alkalisk vand
- 3.2 Elektrolyse med elektrolytisk polymermembran
- 3.3 Elektrolyse med faste oxider
- 4 Hvad er elektrolyse af vand til?
- 4.1 Brintproduktion og dens anvendelser
- 4.2 Som en fejlretningsmetode
- 4.3 Som iltforsyning
- 5 Hjemmeeksperiment
- 5.1 Hjemvariabler
- 6 Referencer
Elektrolysereaktion
Elektrolyse af vand involverer mange komplekse aspekter. Generelt hviler dets basis imidlertid på en simpel global reaktion:
2HtoO (l) => 2Hto(g) + Oto(g)
Som det kan ses af ligningen, er to vandmolekyler involveret: den ene skal normalt reduceres eller vinde elektroner, mens den anden skal oxidere eller miste elektroner..
Hto Det er et produkt af reduktionen af vand, da gevinsten af elektroner fremmer, at H-protonerne+ kan binde kovalent, og iltet omdannes til OH-. Derfor er Hto forekommer ved katoden, som er elektroden, hvor reduktion opstår.
Mens Oto kommer fra oxidation af vand, som det mister elektronerne, der tillader det at binde til brint, og frigiver følgelig protoner H+. Oto den produceres ved anoden, elektroden, hvor oxidation opstår; og i modsætning til den anden elektrode er pH omkring anoden sur og ikke basisk.
Halvcellereaktioner
Dette kan sammenfattes med følgende kemiske ligninger for halvcellereaktioner:
2HtoO + 2e- => Hto + 2OH- (Katode, grundlæggende)
2HtoO => Oto + 4H+ + 4e- (Anode, syre)
Dog kan vand ikke miste flere elektroner (4e-hvoraf det andet vandmolekyle vinder ved katoden (2e-); derfor skal den første ligning ganges med 2 og derefter trækkes med den anden ligning for at opnå netligningen:
2 (2HtoO + 2e- => Hto + 2OH-)
2HtoO => Oto + 4H+ + 4e-
6HtoO => 2Hto + ELLERto + 4H+ + 4OH-
Men 4H+ og 4OH- form 4HtoEller så fjerner disse fire af de seks molekyler af HtoEller efterlade to; og resultatet er den globale reaktion, der lige er rejst.
Halvcellereaktioner ændres med pH-værdier, teknikker og har også tilknyttede reduktions- eller oxidationspotentialer, som bestemmer, hvor meget strøm der skal tilføres for at elektrolysen af vand kan foregå spontant..
Behandle
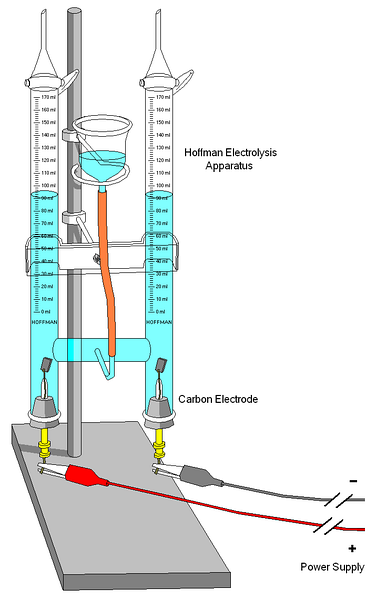
Et Hoffman voltameter er vist på billedet ovenfor. Cylindrene er fyldt med vand og de valgte elektrolytter gennem den midterste dyse. Disse elektrolyters rolle er at øge vandets ledningsevne, fordi der under normale forhold er meget få H-ioner3ELLER+ og OH- produkter af dets selvionisering.
De to elektroder er normalt platin, selvom de i billedet blev erstattet af kulelektroder. Begge er tilsluttet et batteri, hvormed der anvendes en potentiel forskel (AV), der fremmer oxidationen af vand (dannelse af Oto).
Elektronerne bevæger sig hele kredsløbet, indtil de når den anden elektrode, hvor vandet vinder dem og bliver Hto og OH-. På dette tidspunkt er anoden og katoden allerede defineret, som kan differentieres ved højden af vandsøjlerne; den med den laveste højde svarer til katoden, hvor H dannesto.
Øverst på cylindrene er der nøgler, der gør det muligt at frigive de genererede gasser. Tilstedeværelsen af H kan nøje kontrolleresto hvilket får det til at reagere med en flamme, hvis forbrænding producerer gasformigt vand.
Teknikker
Vandelektrolyseteknikker varierer afhængigt af mængden af Hto migto der foreslås at generere. Begge gasser er meget farlige, hvis de blandes sammen, hvorfor elektrolytiske celler involverer komplekse konstruktioner for at minimere stigningen i gasformige tryk og deres diffusion gennem det vandige medium..
Ligeledes varierer teknikkerne afhængigt af cellen, elektrolytten tilsat til vandet og selve elektroderne. På den anden side antyder nogle, at reaktionen udføres ved højere temperaturer, hvilket reducerer elforbruget, og andre bruger enorme pres for at opretholde Hto gemt.
Blandt alle teknikkerne kan følgende tre nævnes:
Elektrolyse med alkalisk vand
Elektrolyse udføres med basiske opløsninger af alkalimetaller (KOH eller NaOH). Med denne teknik forekommer reaktionerne:
4HtoO (l) + 4e- => 2Hto(g) + 4OH-(ac)
4OH-(ac) => Oto(g) + 2HtoO (l) + 4e-
Som det kan ses, både ved katoden og ved anoden, har vand en basisk pH; og desuden OH- migrere til anoden, hvor de oxiderer til Oto.
Elektrolyse med polymer elektrolytisk membran
Denne teknik bruger en fast polymer, der fungerer som en permeabel membran for H+, men uigennemtrængelig for gasser. Dette sikrer større sikkerhed under elektrolyse..
Halvcellereaktionerne i dette tilfælde er:
4H+(ac) + 4e- => 2Hto(g)
2HtoO (l) => Oto(g) + 4H+(ac) + 4e-
H-ioner+ migrere fra anoden til katoden, hvor de reduceres til at blive Hto.
Elektrolyse med faste oxider
Meget forskellig fra andre teknikker, denne bruger oxider som elektrolytter, som ved høje temperaturer (600-900 ° C) fungerer som et middel til at transportere anionen Oto-.
Reaktionerne er:
2HtoO (g) + 4e- => 2Hto(g) + 20to-
2Oto- => Oto(g) + 4e-
Bemærk, at denne gang er det oxidanionerne, Oto-, dem, der rejser til anoden.
Hvad er elektrolyse af vand til?
Elektrolyse af vand producerer Hto (g) og Oto (g). Cirka 5% af den brintgas, der produceres i verden, fremstilles ved elektrolyse af vand.
Hto det er et biprodukt fra elektrolyse af vandige NaCl-opløsninger. Tilstedeværelsen af salt letter elektrolyse ved at øge vandets elektriske ledningsevne.
Den samlede reaktion, der finder sted, er:
2NaCl + 2HtoO => Clto + Hto + 2NaOH
For at forstå den enorme betydning af denne reaktion vil nogle af anvendelserne af gasformige produkter blive nævnt; For i slutningen af dagen er det dem, der driver udviklingen af nye metoder til at opnå elektrolyse af vand på en mere effektiv og grøn måde.
Af dem alle er det mest ønskede at fungere som celler, der energisk erstatter brugen af brændende fossile brændstoffer..
Brintproduktion og dens anvendelser
-Hydrogen produceret i elektrolyse kan anvendes i den kemiske industri, der virker i afhængighedsreaktioner, i hydrogeneringsprocesser eller som et reduktionsmiddel i reduktionsprocesser.
-Ligeledes er det vigtigt i nogle handlinger af kommerciel betydning, såsom: produktion af saltsyre, hydrogenperoxid, hydroxylaminer osv. Det er involveret i syntesen af ammoniak gennem en katalytisk reaktion med nitrogen.
-I kombination med ilt producerer det flammer med et højt kalorieindhold med temperaturer mellem 3.000 og 3.500 K. Disse temperaturer kan bruges til skæring og svejsning i metalindustrien, til vækst af syntetiske krystaller, produktion af kvarts osv..
-Vandbehandling: for højt nitratindhold i vand kan reduceres ved eliminering i bioreaktorer, hvor bakterier bruger brint som energikilde
-Brint er involveret i syntesen af plast, polyester og nylon. Derudover er det en del af produktionen af glas, hvilket øger forbrændingen under bagning..
-Reagerer med oxider og klorid af mange metaller, herunder: sølv, kobber, bly, vismut og kviksølv for at producere rene metaller.
-Og derudover bruges det som brændstof i kromatografisk analyse med en flammedetektor..
Som en fejlretningsmetode
Elektrolysen af natriumchloridopløsninger bruges til at rense swimmingpoolvand. Under elektrolyse produceres hydrogen ved katoden og klor (Clto) ved anoden. Elektrolyse omtales i dette tilfælde som en saltchlorinator.
Klor opløses i vand til dannelse af hypochlorsyre og natriumhypochlorit. Hypochlorsyre og natriumhypochlorit steriliseres vand.
Som iltforsyning
Elektrolyse af vand bruges også til at generere ilt på den internationale rumstation, som tjener til at opretholde en atmosfære af ilt i stationen..
Brint kan bruges i en brændselscelle, en metode til at lagre energi og bruge det vand, der genereres i cellen til forbrug af astronauter.
Hjemmeeksperiment
Vandelektrolyseeksperimenter er blevet udført i laboratorievægte med Hoffman voltmetre eller en anden samling, der gør det muligt at indeholde alle de nødvendige elementer i en elektrokemisk celle..
Af alle mulige samlinger og udstyr kan det enkleste være en stor gennemsigtig vandbeholder, der vil fungere som en celle. Ud over dette skal ethvert metal eller elektrisk ledende overflade også være til stede for at fungere som elektroder; den ene til katoden og den anden til anoden.
Til dette formål kan selv blyanter med skarpe grafitspidser i begge ender være nyttige. Og endelig et lille batteri og nogle kabler, der forbinder det med de improviserede elektroder..
Hvis det ikke udføres i en gennemsigtig beholder, ville dannelsen af luftbobler ikke forstås..
Hjemmevariabler
Selvom elektrolyse af vand er et emne, der indeholder mange spændende og håbefulde aspekter for dem, der leder efter alternative energikilder, kan hjemmeforsøget være kedeligt for børn og andre tilskuere..
Derfor kan tilstrækkelig spænding anvendes til at generere dannelsen af H.to migto skiftevis bestemte variabler og bemærke ændringerne.
Den første af disse er variationen i vandets pH ved hjælp af enten eddike til at forsure vandet eller NatoCO3 at basere det lidt. En ændring skal forekomme i antallet af observerede bobler.
Derudover kunne det samme eksperiment gentages med varmt og koldt vand. På denne måde vil temperaturens indvirkning på reaktionen derefter blive overvejet..
Endelig kan en meget fortyndet opløsning af lilla kåljuice bruges til at gøre dataindsamlingen lidt mindre farveløs. Denne juice er en syre-base indikator af naturlig oprindelse.
Ved at tilføje det til beholderen med de indsatte elektroder bemærkes det, at vandet ved anoden bliver lyserødt (syre), mens farven ved katoden er gul (grundlæggende).
Referencer
- Wikipedia. (2018). Elektrolyse af vand. Gendannet fra: en.wikipedia.org
- Chaplin M. (16. november 2018). Elektrolyse af vand. Vandstruktur og videnskab. Gendannet fra: 1.lsbu.ac.uk
- Energieffektivitet & vedvarende energi. (s.f.). Brintproduktion: elektrolyse. Gendannet fra: energy.gov
- Phys.org. (14. februar 2018). Højeffektiv, billig katalysator til vandelektrolyse. Gendannet fra: phys.org
- Kemi LibreTexts. (18. juni 2015). Elektrolyse af vand. Gendannet fra: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. og S. Lewis N. (2016). Principper og implementeringer af elektrolysesystemer til spaltning af vand. Royal Society of Chemistry.
- Regenter ved University of Minnesota. (2018). Elektrolyse af vand 2. University of Minnesota. Gendannet fra: chem.umn.edu


Endnu ingen kommentarer