
Egenskaber for mikroskopisk skala, optælling af partikler, eksempler
Det mikroskopisk skala Det er en, der bruges til at måle størrelser og længder, der ikke kan ses med det blotte øje, og som er under en millimeter i længden. Fra højeste til laveste er de mikroskopiske skalaer i det metriske system:
- Millimeter (1 mm), som er en tiendedel af en centimeter eller en tusindedel af en meter. I dette er skalaen, vi har en af de største celler i kroppen, som er æg, hvis størrelse er 1,5 mm.
- Tiendedelen af en millimeter (0,1 mm). Dette er skalaen for tykkelsen eller diameteren af et menneskehår.
- Mikrometeret eller mikronen (1 μm = 0,001 mm). På denne skala er plante- og dyreceller og bakterier.
Planteceller er i størrelsesordenen 100 μm. Dyreceller er ti gange mindre, det er i størrelsesordenen 10 μm; mens bakterier er 10 gange mindre end dyreceller og er i størrelsesordenen 1 μm.
Artikelindeks
- 1 nanoskala
- 2 instrumenter til mikroskopisk observation
- 3 Mikroskopiske egenskaber
- 3.1-Matter er et enormt tomrum
- 4 Sådan tælles partikler i mikroskopisk skala?
- 4.1-Eksempel 1
- 4.2-Eksempel 2
- 5 Referencer
Nano skala
Der er målinger endnu mindre end den mikroskopiske skala, men de bruges ikke almindeligt undtagen i nogle specielle sammenhænge. Her er nogle af de vigtigste nanometriske målinger:
- Nanometeret (1 ηm = 0,001 μm = 0,000001 mm) er en milliontedel af en millimeter. På denne skala er der nogle vira og molekyler. Virus er i størrelsesordenen 10ηm og molekyler i størrelsesordenen 1ηm.
- Angstrømmen (1Å = 0,1ηm = 0,0001μm = 10-7mm). Denne måling danner skalaen eller atomstørrelsen.
- Fantomometeret (1fm = 0,00001Å = 0,000001ηm = 10-12mm). Dette er skalaen for atomkerner, som er mellem 10.000 og 100.000 gange mindre end atomet. På trods af sin lille størrelse koncentrerer kernen sig imidlertid 99,99% af atommassen.
- Der er mindre skalaer til atomkernen, da disse består af partikler som protoner og neutroner. Men der er mere: disse partikler består til gengæld af mere grundlæggende partikler som kvarker..
Instrumenter til mikroskopisk observation
Når objekter er mellem millimeter- og mikrometerskalaen (1 mm - 0,001 mm), kan de observeres med et optisk mikroskop.
Men hvis objekterne eller strukturer er mellem nanometer og Ångstrøm, er elektronmikroskoper eller nanoskop påkrævet..
I elektronmikroskopi anvendes i stedet for lys højenergielektroner, der har en meget kortere bølgelængde end lys. Ulempen ved elektronmikroskopet er, at det ikke er muligt at placere levende prøver i det, fordi det fungerer under vakuum..
I stedet bruger nanoskopet laserlys, og det har den fordel i forhold til elektronmikroskopi, at strukturer og molekyler i en levende celle kan ses på og registreres..
Nanoteknologi er den teknologi, hvormed kredsløb, strukturer, dele og endda motorer fremstilles på skalaer, der går fra nanometeret til atomskalaen.
Mikroskopiske egenskaber
I fysik undersøges i en første tilnærmelse opførsel af stof og systemer fra det makroskopiske synspunkt. Fra dette paradigme er stof et uendeligt deleligt kontinuum; og dette synspunkt er gyldigt og velegnet til mange situationer i hverdagen.
Imidlertid kan nogle fænomener i den makroskopiske verden kun forklares, hvis der tages hensyn til materiens mikroskopiske egenskaber..
På det mikroskopiske synspunkt tages materialets molekylære og atomare struktur i betragtning. I modsætning til den makroskopiske tilgang er der på denne skala en granulær struktur med huller og mellemrum mellem molekyler, atomer og endda indeni dem..
Det andet kendetegn fra det mikroskopiske synspunkt i fysikken er, at et stykke stof, uanset hvor lille, er sammensat af et enormt antal partikler adskilt fra hinanden og i kontinuerlig bevægelse..
-Materie er et enormt tomrum
I et lille stykke stof er afstanden mellem atomer enorm sammenlignet med deres størrelse, men igen er atomerne enorme sammenlignet med deres egne kerner, hvor 99,99% af massen er koncentreret..
Det vil sige, at et stykke stof i mikroskopisk skala er et enormt vakuum med koncentrationer af atomer og kerner, der optager en lille brøkdel af det samlede volumen. I denne forstand svarer den mikroskopiske skala til den astronomiske skala..
Fra makroskopiske objekter til opdagelsen af atomet
De første kemikere, som var alkymisterne, indså, at materialerne kunne være af to typer: ren eller sammensat. Således blev idéen om kemiske grundstoffer nået frem.
De første kemiske grundstoffer, der blev opdaget, var de syv metaller fra oldtiden: sølv, guld, jern, bly, tin, kobber og kviksølv. Over tid blev der opdaget mere i det omfang, at der blev fundet stoffer, der ikke kunne nedbrydes til andre.
Derefter blev elementerne klassificeret efter deres egenskaber og egenskaber i metaller og ikke-metaller. Alle dem, der havde lignende egenskaber og kemisk affinitet, blev grupperet i den samme kolonne, og dermed opstod elementernes periodiske system..
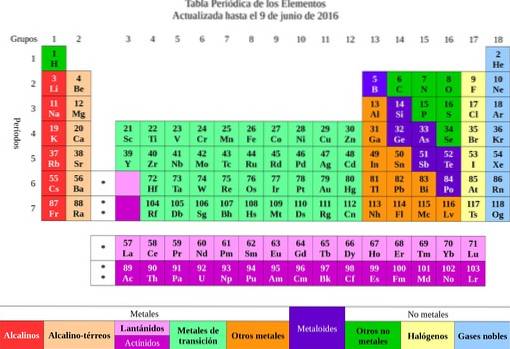
Fra elementerne blev ideen om atomer overført, et ord der betyder udelelig. Kort tid senere indså forskerne, at atomer havde en struktur. Derudover havde atomerne to typer elektrisk ladning (positiv og negativ).
Subatomære partikler
I Rutherfords eksperimenter, hvor han bombarderede atomerne på en tynd guldplade med alfapartikler, blev atomets struktur afsløret: en lille positiv kerne omgivet af elektroner.
Atomer blev fortsat bombarderet med flere og flere energipartikler og gøres stadig for at opklare hemmelighederne og egenskaberne i den mikroskopiske verden i mindre og mindre skala..
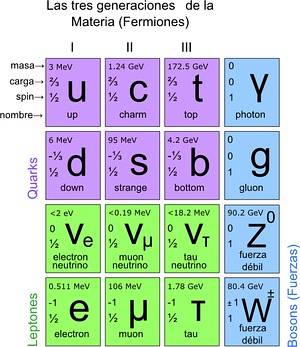
På denne måde blev standardmodellen nået, hvor det fastslås, at de sande elementære partikler er dem, som atomer er sammensat af. Atomer giver igen grundstoffer, disse til forbindelser og alle kendte interaktioner (undtagen tyngdekraft). I alt er der 12 partikler.
Disse grundlæggende partikler har også deres periodiske system. Der er to grupper: de ½-spin fermioniske partikler og de bosoniske. Bosonerne er ansvarlige for interaktionerne. Fermionics er 12 og er dem, der giver anledning til protoner, neutroner og atomer.
Sådan tælles partikler i mikroskopisk skala?
Over tid opdagede kemikere de relative masser af grundstoffer fra nøjagtige målinger i kemiske reaktioner. Således kunne det f.eks. Bestemmes, at kulstof er 12 gange tungere end brint..
Hydrogen blev også bestemt til at være det letteste element, så dette element fik den relative masse 1.
På den anden side krævede kemikere at kende antallet af partikler, der er involveret i en reaktion, så der ikke er noget reagens, der mangler eller mangler. For eksempel kræver et vandmolekyle to hydrogenatomer og et oxygenatomer..
Fra disse fortilfælde er begrebet muldvarpe født. En mol af ethvert stof er et fast antal partikler, der svarer til dets molekylære eller atommasse i gram. Det blev således bestemt, at 12 gram kulstof har det samme antal partikler som 1 gram hydrogen. Dette tal er kendt som Avogadros nummer: 6,02 x 10 ^ 23 partikler.
-Eksempel 1
Beregn, hvor mange guldatomer der er i 1 gram guld.
Opløsning
Guld vides at have en atomvægt på 197. Disse data findes i det periodiske system og indikerer, at et guldatom er 197 gange tungere end et af brint og 197/12 = 16.416 gange tungere end kulstof..
En mol guld har 6,02 × 10 ^ 23 atomer og har atomvægten udtrykt i gram, det vil sige 197 gram.
I et gram guld er der 1/197 mol guld, dvs. 6,02 × 10 ^ 23 atomer / 197 = 3,06 x10 ^ 23 guldatomer.
-Eksempel 2
Bestem antallet af molekyler af calciumcarbonat (CaCO3) der er i 150 gram af dette stof. Fortæl også hvor mange calciumatomer, hvor mange kulstof og hvor mange ilt der er i denne forbindelse.
Opløsning
Den første ting er at bestemme den molekylære masse af calciumcarbonat. Det periodiske system indikerer, at calcium har en molekylvægt på 40 g / mol, carbon 12 g / mol og oxygen 16 g / mol..
Derefter molekylmassen af (CaCO3) vil være :
40 g / mol + 12 g / mol + 3 x 16 g / mol = 100 g / mol
Hver 100 gram calciumcarbonat er 1 mol. Så i 150 gram svarer de til 1,5 mol.
Hver mol carbonat har 6,02 x 10 ^ 23 carbonatmolekyler, så i 1,5 mol carbonat er der 9,03 x 10 ^ 23 molekyler.
Kort sagt, i 150 gram calciumcarbonat er der:
- 9,03 x 10 ^ 23 molekyler af calciumcarbonat.
- Calciumatomer: 9,03 x 10 ^ 23 .
- Også 9,03 x 10 ^ 23 kulstofatomer
- Endelig 3 x 9,03 x 10 ^ 23 iltatomer = 27,09 x 10 ^ 23 iltatomer.
Referencer
- Anvendt biologi. Hvad er de mikroskopiske målinger? Gendannet fra: youtube.com
- Kemisk uddannelse. Makroskopiske, submikroskopiske og symbolske repræsentationer af stof. Gendannet fra: scielo.org.mx.
- García A. Interaktivt fysik kursus. Makro-stater, mikrostater. Temperatur, entropi. Gendannet fra: sc.ehu.es
- Materiens mikroskopiske struktur. Gendannet fra: alipso.com
- Wikipedia. Mikroskopisk niveau. Gendannet fra: wikipedia.com

Endnu ingen kommentarer