
Absorptionsspektrum atomær, synlig og molekylær absorption
EN Absorptionsspektrum Det er produktet af interaktion mellem lys og et materiale eller stof i en hvilken som helst af dets fysiske tilstande. Men definitionen går ud over et simpelt synligt lys, da interaktionen inkluderer et bredt segment af området for bølgelængder og energi fra elektromagnetisk stråling..
Derfor kan nogle faste stoffer, væsker eller gasser absorbere fotoner med forskellige energier eller bølgelængder; fra ultraviolet stråling efterfulgt af synligt lys til stråling eller infrarødt lys, der træder ind i mikrobølgelængder.

Det menneskelige øje opfatter kun stofens interaktioner med synligt lys. Ligeledes er det i stand til at overveje diffraktion af hvidt lys gennem et prisme eller et medium i dets farverige komponenter (øverste billede).
Hvis lysstrålen blev "fanget" efter at have bevæget sig gennem et materiale og analyseret, ville fraværet af visse farvebånd blive fundet; det vil sige, at sorte striber observeres i kontrast til dens baggrund. Dette er absorptionsspektret, og dets analyse er grundlæggende inden for instrumental analytisk kemi og astronomi..
Artikelindeks
- 1 Atomabsorption
- 1.1 Overgange og elektroniske energier
- 2 Synligt spektrum
- 3 Absorptionsspektrum af molekyler
- 3.1 Methylenblåt
- 3.2 Klorofyl a og b
- 4 Referencer
Atomabsorption
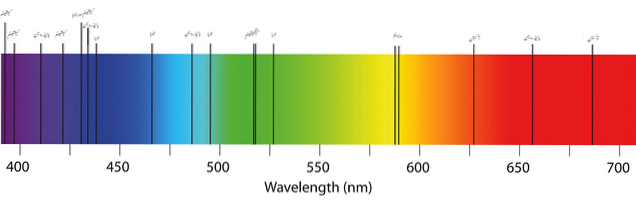
Det øverste billede viser et typisk absorptionsspektrum for elementerne eller atomer. Bemærk, at de sorte bånd repræsenterer de absorberede bølgelængder, mens de andre er de udsendte. Dette betyder, at et atomemissionsspektrum derimod ligner et sort bånd med striber af udsendte farver..
Men hvad er disse striber? Hvordan ved jeg kort om atomerne absorberer eller udsender (uden at indføre fluorescens eller fosforescens)? Svarene ligger i atomernes tilladte elektroniske tilstande.
Elektroniske overgange og energier
Elektroner er i stand til at bevæge sig væk fra kernen og lade den være positivt ladet, mens de passerer fra en orbital med lavere energi til en højere energi. Til dette, forklaret af kvantefysik, absorberer de fotoner med en bestemt energi til at udføre den elektroniske overgang..
Derfor kvantiseres energien, og de absorberer ikke halvdelen eller tre fjerdedele af en foton, men specifikke frekvensværdier (ν) eller bølgelængder (λ).
Når elektronen er ophidset, forbliver den ikke i ubegrænset tid i den elektroniske tilstand med højere energi; frigiver energien i form af en foton, og atomet vender tilbage til sin basale eller oprindelige tilstand.
Afhængigt af om de absorberede fotoner er optaget, opnås et absorptionsspektrum; og hvis de udsendte fotoner registreres, bliver resultatet et emissionsspektrum.
Dette fænomen kan observeres eksperimentelt, hvis gasformige eller forstøvede prøver af et element opvarmes. I astronomi kan en stjernesammensætning kendes ved at sammenligne disse spektre og endda dens placering i forhold til jorden..
Synligt spektrum
Som det kan ses på de to første billeder, inkluderer det synlige spektrum farver fra violet til rødt og alle deres nuancer med hensyn til, hvor meget materialet absorberer (mørke nuancer).
Bølgelængderne for rødt lys svarer til værdier fra 650 nm og frem (indtil de forsvinder i infrarød stråling). Og yderst til venstre dækker de violette og lilla toner bølgelængdeværdierne op til 450 nm. Det synlige spektrum varierer derefter fra ca. 400 til 700 nm.
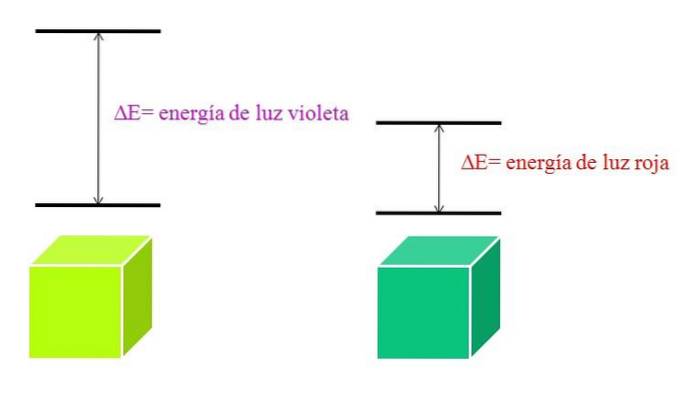
Efterhånden som λ øges, falder frekvensen af foton og dermed dets energi. Således har violet lys højere energi (kortere bølgelængder) end rødt lys (længere bølgelængder). Derfor involverer et materiale, der absorberer lilla lys, elektroniske overgange af højere energier..
Og hvis materialet absorberer farven violet, hvilken farve vil den reflektere? Det vil fremstå som en grønlig gul farve, hvilket betyder, at dens elektroner foretager meget energiske overgange; mens materialet absorberer den lavere energirøde farve, vil det reflektere en blågrøn farve.
Når et atom er meget stabilt, udviser det generelt meget fjerne elektroniske tilstande i energi; og derfor bliver du nødt til at absorbere fotoner med højere energi for at tillade elektroniske overgange:
Absorptionsspektrum af molekyler
Molekyler har atomer, og disse absorberer også elektromagnetisk stråling; dog er deres elektroner en del af den kemiske binding, så deres overgange er forskellige. En af de store triumfer i den molekylære orbitalteori er evnen til at relatere absorptionsspektrene med den kemiske struktur.
Således har enkelt-, dobbelt-, tredobbelt-, konjugerede bindinger og aromatiske strukturer deres egne elektroniske tilstande; og absorberer derfor meget specifikke fotoner.
Ved at have flere atomer ud over intermolekylære interaktioner og vibrationerne af deres bindinger (som også absorberer energi) har absorptionsspektrene af molekylerne form af "bjerge", som indikerer de bånd, der omfatter bølgelængderne, hvor elektroniske overgange forekommer.
Takket være disse spektre kan en forbindelse karakteriseres, identificeres og endda kvantificeres gennem multivariat analyse.
Methylenblåt
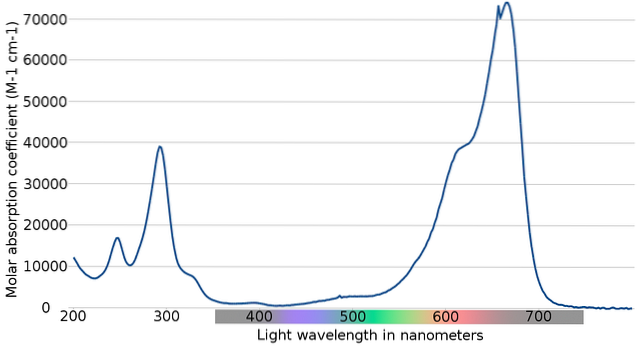
Det øverste billede viser spektret af den methylenblå indikator. Som navnet åbenbart antyder, er det blåt i farven; men kan det verificeres med dets absorptionsspektrum?
Bemærk, at der er bånd mellem bølgelængderne på 200 og 300 nm. Mellem 400 og 500 nm er der næsten ingen absorption, det vil sige, at den ikke absorberer violette, blå eller grønne farver.
Den har dog et stærkt absorptionsbånd efter 600 nm og har derfor lavenergiske elektroniske overgange, der absorberer fotoner af rødt lys..
Derfor og på grund af de høje værdier af molære absorptionsevner udviser methylenblåt en intens blå farve..
Klorofyl a og b
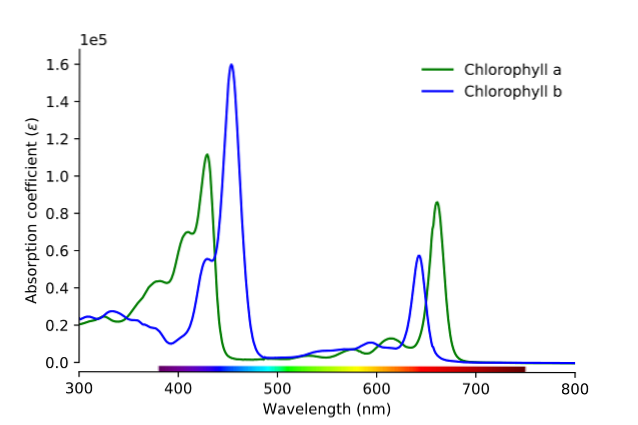
Som det kan ses på billedet, svarer den grønne linje til absorptionsspektret for klorofyl a, mens den blå linje svarer til klorofyl b.
For det første skal båndene, hvor de molære absorptionsevner er størst, sammenlignes; i dette tilfælde de til venstre mellem 400 og 500 nm. Klorofyl a absorberer stærkt lilla farver, mens klorofyl b (blå linje) absorberer blå farver.
Ved at absorbere klorofyl b omkring 460 nm reflekteres den blå, den gule farve. På den anden side absorberer det også stærkt nær 650 nm, orange lys, hvilket betyder, at det udviser farven blå. Hvis gul og blå blandes, hvad er resultatet? Farven grøn.
Og endelig absorberer klorofyl a den blåviolette farve og også et rødt lys nær 660 nm. Derfor har den en grøn farve “blødgjort” af gul..
Referencer
- Observatoire de Paris. (s.f.). De forskellige klasser af spektre. Gendannet fra: media4.obspm.fr
- Rabanales University Campus. (s.f.). Spektrofotometri: Absorptionsspektre og kolorimetrisk kvantificering af biomolekyler. [PDF]. Gendannet fra: uco.es
- Day, R., & Underwood, A. (1986). Kvantitativ analytisk kemi (femte udgave). PEARSON, Prentice Hall, s 461-464.
- Reush W. (s.f.). Synlig og ultraviolet spektroskopi. Gendannet fra: 2.chemistry.msu.edu
- David Darling. (2016). Absorptionsspektrum. Gendannet fra: daviddarling.info
- Khan Academy. (2018). Absorptions- / emissionsledninger. Gendannet fra: khanacademy.org

Endnu ingen kommentarer