
Ethylenglycolegenskaber, kemisk struktur, anvendelser
Det ethylenglycol det er den enkleste organiske forbindelse i glykolfamilien. Dens kemiske formel er CtoH6ELLERto, mens dens strukturformel er HOCHto-CHtoOH. En glycol er en alkohol, der er karakteriseret ved at have to hydroxylgrupper (OH) bundet til to tilstødende carbonatomer i en alifatisk kæde.
Ethylenglykol er en klar, farveløs og lugtfri væske. På billedet nedenfor har du en prøve af ham i en krukke. Derudover har den en sød smag og er meget hygroskopisk. Det er en let flygtig væske, så den udøver et meget lille damptryk, hvor dampens densitet er større end densiteten af luft..

Ethylenglycol er en forbindelse med stor opløselighed i vand ud over at være blandbar med mange organiske forbindelser; såsom kortkædede alifatiske alkoholer, acetone, glycerol osv. Dette skyldes deres evne til at donere og acceptere hydrogenbindinger fra protiske opløsningsmidler (som har H).
Ethylenglycol polymeriserer i mange forbindelser, hvis navne ofte forkortes til PEG og et tal, der angiver deres omtrentlige molekylvægt. PEG 400 er for eksempel en relativt lille, flydende polymer. Mens store PEG'er er hvide faste stoffer med et fedtet udseende.
Egenskaben ved ethylenglycol til at nedsætte smeltepunktet og øge kogepunktet for vand, tillader dets anvendelse som kølemiddel og antikoagulant i køretøjer, fly og computerudstyr.
Artikelindeks
- 1 egenskaber
- 1.1 Navne
- 1.2 Molær masse
- 1.3 Fysisk udseende
- 1.4 Lugt
- 1.5 Smag
- 1.6 Massefylde
- 1.7 Smeltepunkt
- 1.8 Kogepunkt
- 1.9 Opløselighed i vand
- 1.10 Opløselighed i andre opløsningsmidler
- 1.11 Flammepunkt
- 1.12 Dampmassefylde
- 1.13 Damptryk
- 1.14 Nedbrydning
- 1.15 Opbevaringstemperatur
- 1.16 Forbrændingsvarme
- 1.17 Fordampningsvarme
- 1.18 Overfladespænding
- 1.19 Brydningsindeks
- 1,20 Dissociationskonstant
- 1,21 pH
- 1.22 Octanol / vand fordelingskoefficient
- 2 Kemisk struktur
- 3 Produktion
- 3.1 Oxidation af ethylen
- 3.2 Hydrolyse af ethylenoxid
- 3.3 Omega-proces
- 4 anvendelser
- 4.1 Kølevæske og frostvæske
- 4.2 Dehydrering
- 4.3 Fremstilling af polymerer
- 4.4 Eksplosiver
- 4.5 Træbeskyttelse
- 4.6 Andre applikationer
- 5 Forgiftning og risici
- 5.1 Symptomer ved eksponering
- 5.2 Indtagelsesskader
- 5.3 Økologiske konsekvenser af ethylenglycol
- 6 Referencer
Ejendomme
Navne
Ethan-1,2-diol (IUPAC), ethylenglycol, monoethylenglycol (MEG), 1-2-dihydroxyethan.
Molar masse
62,068 g / mol
Fysisk fremtoning
Klar, farveløs og tyktflydende væske.
Lugt
Toilet
Smag
Slik
Massefylde
1,1132 g / cm3
Smeltepunkt
-12,9 ºC
Kogepunkt
197,3 ºC
Vandopløselighed
Blandbar med vand, meget hygroskopisk forbindelse.
Opløselighed i andre opløsningsmidler
Blandbar med lavere alifatiske alkoholer (methanol og ethanol), glycerol, eddikesyre, acetone og lignende ketoner, aldehyder, pyridin, kultjærebaser og opløselige i ether. Praktisk talt uopløselig i benzen og dets homologer, chlorerede carbonhydrider, petroleumsether og olier.
antændelsespunkt
111 ºC
Dampmassefylde
2.14 i forhold til luft taget som 1.
Damptryk
0,092 mmHg ved 25 ° C (ved ekstrapolering).
Nedbrydning
Når det opvarmes til nedbrydning, udsender det en skarp og irriterende røg.
Stuetemperatur
2-8 ºC
Forbrændingsvarme
1.189,2 kJ / mol
Fordampningsvarme
50,5 kJ / mol
Overfladespænding
47,99 mN / m ved 25 ºC
Brydningsindeks
1,4318 ved 20 ºC
Dissociation konstant
pKa = 14,22 ved 25 ºC
pH
6 til 7,5 (100 g / l vand) ved 20 ºC
Fordelingskoefficient for oktanol / vand
Log P = - 1,69
Kemisk struktur
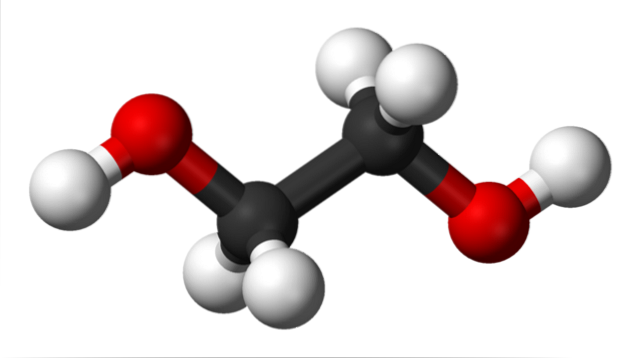
På det øverste billede har vi ethylenglycolmolekylet repræsenteret af en model af kugler og søjler. De sorte kugler svarer til kulstofatomer, der udgør deres C-C skelet, og i deres ender har vi de røde og hvide kugler for henholdsvis ilt- og brintatomerne..
Det er et symmetrisk molekyle, og ved første øjekast kan man tro, at det har et permanent dipolmoment; deres C-OH-bindinger roterer imidlertid, hvilket favoriserer dipolen. Det er også et dynamisk molekyle, der gennemgår konstante rotationer og vibrationer og er i stand til at danne eller modtage hydrogenbindinger takket være dets to OH-grupper..
Faktisk er disse interaktioner ansvarlige for ethylenglycol med så højt kogepunkt (197 ºC).
Når temperaturen falder til -13 ºC, samler molekylerne sig i en orthorhombisk krystal, hvor rotamerer spiller en vigtig rolle; der er molekyler, der har deres O-H-grupper orienteret i forskellige retninger.
Produktion
Ethylenoxidation
Det indledende trin i syntesen af ethylenglycol er oxidationen af ethylen til ethylenoxid. Tidligere blev ethylen omsat med hypochlorsyre til dannelse af chlorhydrin. Dette blev derefter behandlet med calciumhydroxid til dannelse af ethylenoxid..
Chlorhydrinmetoden er ikke særlig rentabel, og der blev skiftet til en metode til direkte oxidation af ethylen i nærværelse af luft eller ilt ved anvendelse af sølvoxid som katalysator..
Ethylenoxidhydrolyse
Hydrolyse af ethylenoxid (EO) med vand under tryk frembringer en rå blanding. Vand-glycol-blandingen inddampes og recirkuleres, idet monoethylenglycol adskilles fra diethylenglycol og triethylenglycol ved fraktioneret destillation..
Ethylenoxidhydrolysereaktionen kan skitseres som følger:
CtoH4O + HtoO => OH-CHto-CHto-OH (ethylenglycol eller monoethylenglycol)
Mitsubishi Chemical udviklede en katalytisk proces ved anvendelse af fosfor i omdannelsen af ethylenoxid til monoethylenglycol.
Omega-proces
I Omega-processen omdannes ethylenoxid oprindeligt til ethylencarbonat gennem dets reaktion med kuldioxid (COto). Derefter underkastes ethylencarbonatet en katalytisk hydrolyse til opnåelse af monoethylenglycol med 98% selektivitet.
Der er en relativt ny metode til syntese af ethylenglycol. Dette består af den oxidative carbonylering af methanol til dimethyloxalat (DMO) og dens efterfølgende hydrogenering til ethylenglycol..
Ansøgninger
Kølevæske og frostvæske
Blandingen af ethylenglycol med vand tillader et fald i frysepunktet og en stigning i kogepunktet, så bilmotorer ikke fryser om vinteren eller overophedes om sommeren.
Når procentdelen af ethylenglycol i blandingen med vand når 70%, er frysepunktet -55 ºC, så ethylenglycol-vandblandingen kan bruges som kølevæske og beskyttelse mod frysning under de forhold, hvor den kan forekomme.
De lave frysetemperaturer af ethylenglycolopløsninger tillader dets anvendelse som frostvæske i bilmotorer; afisning af flyvinger; og ved afisning af forruderne.
Det bruges også til at bevare biologiske prøver, der er bevaret ved lave temperaturer, og derved undgå dannelse af krystaller, der kan skade strukturen af prøverne..
Det høje kogepunkt gør det muligt at bruge ethylenglycolopløsninger til at opretholde lave temperaturer i enheder eller udstyr, der genererer varme under drift, såsom: biler, computerudstyr, klimaanlæg osv..
Dehydrering
Ethylenglycol er en meget hygroskopisk forbindelse, som har gjort det muligt at behandle gasser, der er ekstraheret fra undergrunden, og som har et højt indhold af vanddampe. Eliminering af vand fra naturlige gasser favoriserer deres effektive anvendelse i deres respektive industrielle processer..
Polymerfremstilling
Ethylenglycol anvendes til syntese af polymerer, såsom polyethylenglycol (PEG), polyethylenterephthalat (PET) og polyurethan. PEG'er er en familie af polymerer, der anvendes i applikationer som: madfortykning, forstoppelsesbehandling, kosmetik osv..
PET bruges til fremstilling af alle slags engangsbeholdere, der bruges i forskellige typer drikkevarer og mad. Polyurethan bruges som varmeisolator i køleskabe og som fyldstof i forskellige møbler.
Eksplosiver
Det bruges til fremstilling af dynamit, så det ved at have et fald i nitroglycerins frysepunkt kan opbevares med mindre risiko..
Træbeskyttelse
Ethylenglycol bruges til behandling af træ for at beskytte det mod dets rådne, produceret af svampe. Dette er vigtigt for bevarelsen af museumskunstværker.
Andre apps
Ethylenglycol er til stede i medier til suspension af ledende salte i elektrolytiske kondensatorer og i soja-skumstabilisatorer. Det bruges også til fremstilling af blødgørere, elastomerer og syntetiske voksarter.
Ethylenglycol anvendes til adskillelse af aromatiske og paraffiniske carbonhydrider. Derudover bruges det til fremstilling af rengøringsmidler til rengøringsudstyr. Øger viskositeten og mindsker blækets flygtighed, hvilket gør det lettere at bruge.
Ethylenglycol kan også anvendes i støberiet til støbning af sand og som et smøremiddel under formaling af glas og cement. Det bruges også som en ingrediens i hydrauliske bremsevæsker og som et mellemprodukt i syntesen af estere, ethere, polyesterfibre og harpikser..
Blandt harpikser, hvori ethylenglycol anvendes som råmateriale, er alkyden, der anvendes som base af alkydmalinger, anvendt i bil- og arkitektmaling..
Forgiftning og risici
Symptomer ved eksponering
Ethylenglycol har lav akut toksicitet, når det virker ved kontakt med huden eller ved indånding. Men dets toksicitet manifesteres fuldt ud, når det indtages, idet det angives som den dødelige dosis ethylenglycol på 1,5 g / kg kropsvægt eller 100 ml for en 70 kg voksen..
Akut eksponering for ethylenglycol giver følgende symptomer: indånding forårsager hoste, svimmelhed og hovedpine. På huden opstår der tørhed ved kontakt med ethylenglycol. I mellemtiden producerer det i øjnene rødme og smerte.
Indtagelseskader
Indtagelse af ethylenglycol manifesteres ved mavesmerter, kvalme, bevidstløshed og opkastning. Et overdreven indtag af ethylenglycol har en skadelig virkning på centralnervesystemet (CNS), kardiovaskulær funktion og nyremorfologi og fysiologi..
På grund af svigt i funktion af CNS opstår lammelse eller uregelmæssig øjenbevægelse (nystagmus). I det kardiopulmonale system er der højt blodtryk, takykardi og mulig hjertesvigt. Der er alvorlige ændringer i nyrerne, et produkt af forgiftningen med ethylenglycol.
Udvidelse, degeneration og afsætning af calciumoxalat forekommer i nyretubuli. Sidstnævnte forklares med følgende mekanisme: ethylenglycol metaboliseres af mælke-dehydrogenase-enzymet til dannelse af glycoaldehyd.
Glycoaldehyd giver anledning til glykolsyre, glyoxylsyre og oxalsyre. Oxalsyre udfældes hurtigt med calcium til dannelse af calciumoxalat, hvis uopløselige krystaller deponeres i nyretubuli, hvilket medfører morfologiske ændringer og dysfunktion i dem, hvilket kan føre til nyresvigt..
På grund af toksiciteten af ethylenglycol er det i nogle af dets anvendelser gradvist blevet erstattet af propylenglycol.
Økologiske konsekvenser af ethylenglycol
Under deres afisning frigiver fly betydelige mængder ethylenglycol, som ender med at akkumulere på landingsstrimlerne, som når de vaskes får vandet til at overføre ethylenglycol gennem afløbssystemet til floderne, hvor dets toksicitet påvirker flyet. fisk.
Men toksiciteten af ethylenglycol er ikke i sig selv hovedårsagen til økologisk skade. Under dens aerobe bionedbrydning forbruges en betydelig mængde ilt, hvilket forårsager dens fald i overfladevand.
På den anden side kan dets anaerobe biologiske nedbrydning frigive giftige stoffer til fisk, såsom acetaldehyd, ethanol, acetat og methan..
Referencer
- Wikipedia. (2019). Ethylenglycol. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. PubChem-database. (2019). 1,2-etandiol. CID = 174. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Ethylenglykol: struktur, formel og anvendelser. Undersøgelse. Gendannet fra: study.com
- Leroy G. Wade. (27. november 2018). Ethylenglycol. Encyclopædia Britannica. Gendannet fra: britannica.com
- A. Dominic Fortes & Emmanuelle Suard. (2011). Krystalstrukturer af ethylenglycol og ethylenglycolmonohydrat. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24. december 2010). Ethylenglycol (EG) produktions- og fremstillingsproces. Gendannet fra: icis.com
- Lucy Bell Young. (2019). Hvad bruger Ethylenglycol? ReAgent. Gendannet fra: chemicals.co.uk
- QuimiNet. (2019). Oprindelse, typer og anvendelser af ethylenglykoler. Gendannet fra: quiminet.com
- R. Gomes, R. Liteplo og M.E. Saktmodige. (2002). Ethylenglycol: Human Health Aspects. Verdenssundhedsorganisationen Genève. [PDF]. Gendannet fra: who.int

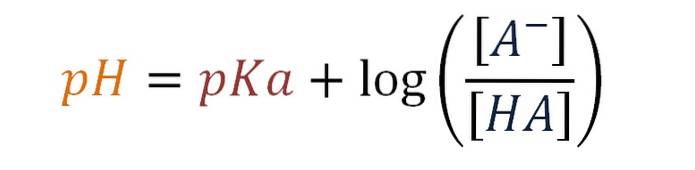

Endnu ingen kommentarer