
Dipole øjeblik, hvordan det beregnes, og eksempler
Det dipolmoment er en kemisk egenskab, der indikerer, hvordan heterogent elektriske ladninger fordeles i et molekyle. Det udtrykkes i Debye-enheder, 3,33 · 10-30 C · m, og dens værdier varierer generelt fra 0 til 11 D.
Meget polære forbindelser har tendens til at have store dipolmomenter; mens de apolære, små dipolmomenter. Jo mere polariserede de elektriske ladninger er i et molekyle, jo større er dets dipolmoment; der skal være en region rig på elektroner, δ- og en anden fattig på elektroner, δ+.

Dipolmomentet, μ, er en vektorstørrelse, så det påvirkes af bindingsvinklerne og generelt af molekylstrukturen.
Når molekylet er lineært, kan det sammenlignes med et tofarvet viskelæder. Dens negative ende δ- svarer til farven rød; mens det positive, δ +, ville være den blå farve. Når størrelsen af de negative ladninger ved δ-polen stiger, og afstanden, der adskiller den fra δ +, øges dipolmomentet.
Kemisk betyder dette, at jo større forskellen i elektronegativitet mellem to atomer er, og jo længere afstanden, der adskiller dem, jo større er dipolmomentet mellem dem..
Artikelindeks
- 1 Hvordan beregnes dipolmomentet?
- 2 Eksempler
- 2.1 Vand
- 2.2 Methanol
- 2.3 Ammoniak
- 2.4 Ethanol
- 2.5 Kuldioxid
- 2.6 Metan
- 3 Referencer
Hvordan beregner du dipolmomentet?
Det betragtes som en kovalent binding mellem to atomer, A og B:
A-B
Afstanden mellem de positive og negative delladninger er allerede defineret af længden af deres obligation:
TILδ+-Bδ-
Fordi protoner og elektroner har samme størrelsesorden elektrisk ladning, men med modsatte tegn, 1.6 · 10-19C, dette er den, der tages i betragtning ved evaluering af dipolmomentet mellem A og B ved hjælp af følgende ligning:
μ = δd
Hvor μ er dipolmomentet, δ er elektronens ladning uden det negative tegn, og d længden af linket udtrykt i meter. For eksempel hvis vi antager det d har en værdi på 2 Å (1 10-10m) dipolmomentet, μA-B vil være:
μA-B = (1,6 10-19C) · (2 · 10-10m)
= 3,210-29C m
Men da denne værdi er meget lille, bruges Debye-enheden:
μ = (3.210-29C · m) · (1 D / 3,33 · 10-30 C m)
= 9,60 D
Denne værdi af μA-B kunne give at antage, at bindingen AB er mere ionisk end kovalent.
Eksempler
Vand
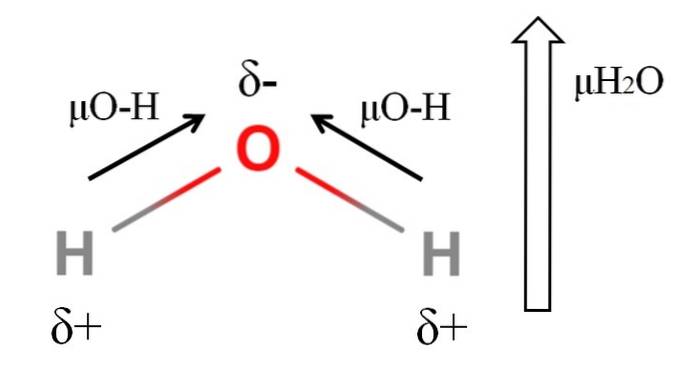
For at beregne dipolmomentet for et molekyle skal alle dipolmomenterne for deres respektive bindinger tilføjes vektorielt i betragtning af bindingsvinklerne og lidt trigonometri. Dette i starten.
Vand har et af de største dipolmomenter, der kunne forventes for en kovalent forbindelse. I det øverste billede har vi, at hydrogenatomer har positive partielle ladninger, δ +, mens ilt bærer en negativ delvis ladning, δ-. O-H-bindingen er ret polær (1,5D), og der er to af dem i et H-molekyletoELLER.
Normalt tegnes en vektor, der er rettet fra det mindst elektronegative atom (H) til det mest elektronegative (O). Selvom de ikke er tegnet, er der på oxygenatomet to par ikke-delte elektroner, som yderligere "koncentrerer" den negative region..
På grund af H's vinkelgeometritoEller dipolmomenterne tilføjes i retning af iltatom. Bemærk, at summen af de to μO-H ville give 3D (1,5 + 1,5); men det er ikke sådan. Dipolmomentet af vand har en eksperimentel værdi på 1,85D. Effekten af den nærmeste vinkel på 105 ° mellem H-O-H-bindingerne er vist her..
Methanol
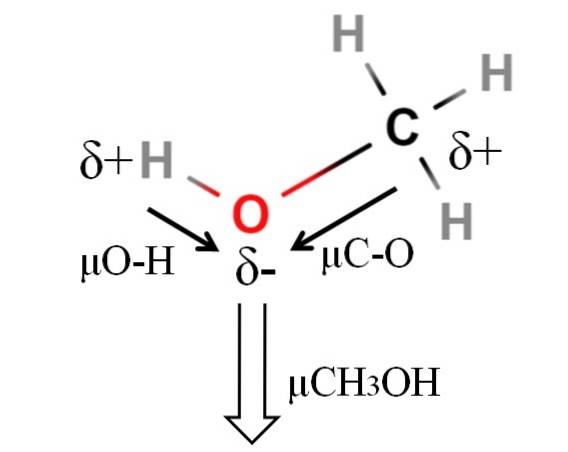
Dipolmomentet for methanol er 1,69 D. Det er mindre end for vand. Derfor har atommasserne ikke meget indflydelse på dipolmomentet; men deres atomare radier er. I tilfælde af methanol kan vi ikke bekræfte, at dens H-O-binding har en μ lig med 1,5D; siden molekylære miljøer er forskellige i CH3OH og HtoELLER.
Derfor skulle længden af H-O-bindingen i methanol måles for at beregne μO-H. Hvad man kan sige er, at μO-H er større end μC-O, da forskellen mellem elektronegativitet mellem kulstof og ilt er mindre end mellem brint og ilt..
Methanol er angivet som et af de mest polære opløsningsmidler, der kan findes sammen med vand og ammoniak..
Ammoniak
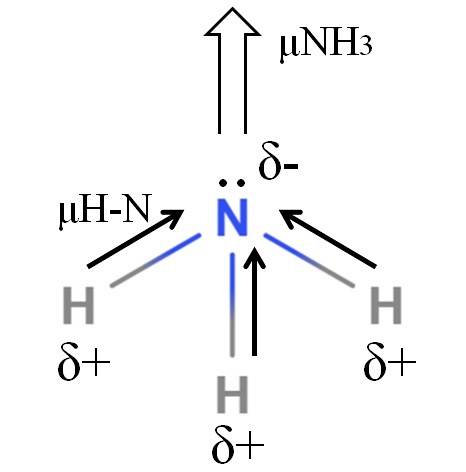
HN-bindingerne er ret polære, så kvælstof tiltrækker elektroner mod sig selv på grund af sin højere elektronegativitet (øverste billede). Ud over dette har vi et ikke-delt par elektroner, som bidrager med deres negative ladninger til δ-regionen. Derfor er elektriske ladninger dominerende på ammoniakens nitrogenatom..
Ammoniak har et dipolmoment på 1,42 D, mindre end methanol. Hvis både ammoniak og methanol kunne omdannes til træk, ville det ses, at methanoludkastet har mere definerede poler sammenlignet med ammoniakudkastet.
Ethanol
I tilfælde af ethanol har CH3CHtoOH, dets dipolmoment er meget tæt på methanol, men det har tendens til at have lavere værdier. Da der er flere carbonatomer, der udgør δ + -regionen, begynder iltatomet, der repræsenterer δ-, at miste lidt af sin "relative negative intensitet".
Carbondioxid
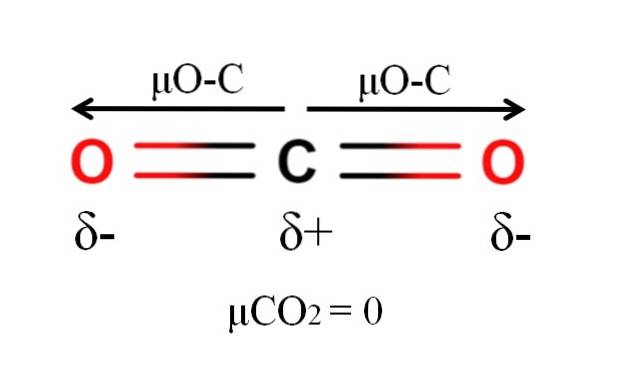
Kuldioxid har to polære bindinger, C = O, med deres respektive dipolmomenter μO-C. Som det kan ses på billedet ovenfor, er den lineære geometri af CO imidlertidto får de to μO-C til at annullere hinanden vektor, selv når kulstof har en positiv delvis ladning og oxygener har negative delvise ladninger.
Af denne grund er kuldioxid et apolært molekyle, da μCOto har en værdi på 0D.
Metan
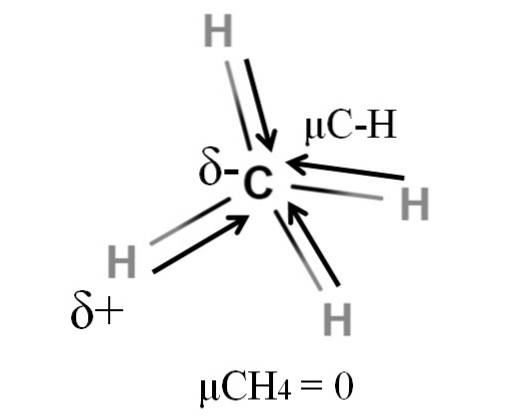
Både metan og kuldioxid deler noget til fælles: de er meget symmetriske molekyler. Generelt er det, at jo mere symmetrisk et molekyle er, jo mindre er dets dipolmoment..
Hvis vi ser CH-molekylet4, dens CH-bindinger er polære, og elektronerne er rettet mod kulstofatomet, fordi det er lidt mere elektronegativt. Man kunne tro, at kulstof skulle være en meget negativ δ-region; som et viskelæder med sit dyprøde centrum og blålig ender.
Men ved at opdele CH4 i halvdelen ville vi få to HC-H-halvdele, den ene til venstre og den anden til højre, svarende til H-molekylettoO. Således ville dipolmomentet som følge af tilsætning af disse to μC-H annullere med det for den anden halvdel. Og derfor, μCH4 har en værdi på 0D.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Walter J. Moore. (1963). Fysisk kemi. I kemisk kinetik. Fjerde udgave, Longmans.
- Ira N. Levine. (2009). Principper for fysisk-kemi. Sjette udgave, s. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29. januar 2020). Dipole Moment Definition. Gendannet fra: thoughtco.com
- Blaber Mike. (29. september 2019). Dipole øjeblikke. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- LaRita Williams. (2020). Dipole Moment: Definition, ligning og eksempler. Undersøgelse. Gendannet fra: study.com
- Wikipedia. (2020). Bond dipol øjeblik. Gendannet fra: en.wikipedia.org


Endnu ingen kommentarer