
Kompressibilitetsfaktor, hvordan man beregner, eksempler og øvelser
Det kompressionsfaktor Z, eller kompressionsfaktor for gasser, er en dimensionsløs værdi (uden enheder), der introduceres som en korrektion i tilstandsligningen af ideelle gasser. På denne måde ligner den matematiske model mere gasens observerede opførsel..
I den ideelle gas er tilstandsligningen, der vedrører variablerne P (tryk), V (volumen) og T (temperatur): P.V ideel = n.R.T med n = antal mol og R = ideel gaskonstant. Tilføjelse af korrektionen for kompressibilitetsfaktoren Z bliver denne ligning:
P.V = Z.n.R.T
Artikelindeks
- 1 Sådan beregnes kompressibilitetsfaktor?
- 2 Eksempler
- 2.1 Kompressionsfaktoren i ideelle gasser, luft, brint og vand
- 3 Løst øvelser
- 3.1 Øvelse 1
- 3.2 Øvelse 2
- 4 Referencer
Sådan beregnes kompressibilitetsfaktor?
Under hensyntagen til, at molvolumen er Vfedt nok = V / n, vi har det virkelige molære volumen:
P . Vægte = Z. R. T → Z = PV ægte/ RT
Da kompressibilitetsfaktoren Z afhænger af gasforholdene, udtrykkes den som en funktion af tryk og temperatur:
Z = Z (P, T)
Ved at sammenligne de to første ligninger kan det ses, at hvis antallet af mol n er lig med 1, er molvolumenet af en reel gas relateret til det for den ideelle gas ved:
Vægte / Videel = Z → V ægte = Z Videel
Når trykket overstiger 3 atmosfærer, holder de fleste gasser op med at opføre sig som ideelle gasser, og det virkelige volumen adskiller sig markant fra det ideelle.
Dette blev realiseret i hans eksperimenter af den hollandske fysiker Johannes Van der Waals (1837-1923), som fik ham til at skabe en model, der var bedre egnet til praktiske resultater end den ideelle gasligning: Van-ligningen af staten..
Eksempler
Ifølge ligningen P.Vægte= Z.n.RT, For en ideel gas er Z = 1. Imidlertid øges værdien af Z i rigtige gasser, når trykket øges. Dette giver mening, fordi jo højere tryk gasmolekylerne har flere muligheder for at kollidere, stiger de frastødende kræfter og med det lydstyrken.
På den anden side bevæger molekylerne sig ved lavere tryk mere frit, og de frastødende kræfter falder. Derfor forventes et lavere volumen. Med hensyn til temperaturen, når den stiger, falder Z.
Som Van der Waals bemærkede, i nærheden af det såkaldte kritiske punkt, afviger gassens opførsel meget fra en idealgas..
Det kritiske punkt (Tc, Pc) af ethvert stof er de tryk- og temperaturværdier, der bestemmer dets opførsel inden en faseændring:
-Tc er den temperatur, over hvilken den pågældende gas ikke flydende.
-Pc er det mindste tryk, der kræves for at flyde gassen ved temperatur Tc
Hver gas har sit eget kritiske punkt, dog definerer temperaturen og det reducerede tryk Tr Og sr som følger:
Pr = P / Pc
Vr = V / V.c
Tr = T / Tc
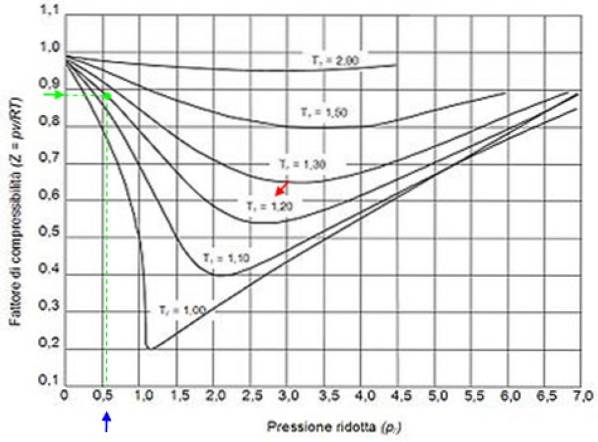
Det observeres, at en begrænset gas med identisk Vr Y Tr udøver det samme tryk Pr. Af denne grund, hvis Z er tegnet som en funktion af Pr til sig selv Tr, hvert punkt på denne kurve er det samme for enhver gas. Dette kaldes princippet for tilsvarende stater.
Kompressionsfaktoren i ideelle gasser, luft, brint og vand
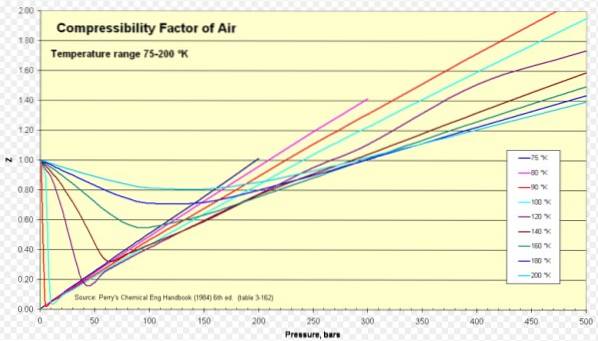
Nedenfor er en kompressibilitetskurve for forskellige gasser ved forskellige reducerede temperaturer. Her er nogle eksempler på Z for nogle gasser og en procedure til at finde Z ved hjælp af kurven.
Ideelle gasser
Ideelle gasser har Z = 1 som forklaret i starten.
Luft
For luft er Z ca. 1 i en lang række temperaturer og tryk (se figur 1), hvor den ideelle gasmodel giver meget gode resultater.
Brint
Z> 1 for alle tryk.
Vand
For at finde Z til vand har du brug for de kritiske punktværdier. Vandets kritiske punkt er: Pc = 22,09 MPa og Tc= 374,14 ° C (647,3 K). Igen skal det tages i betragtning, at kompressibilitetsfaktoren Z afhænger af temperatur og tryk..
Antag for eksempel, at du vil finde Z vand ved 500 ºC og 12 MPa. Derefter er den første ting at gøre, at beregne den reducerede temperatur, for hvilken grader Celsius skal konverteres til Kelvin: 50 ºC = 773 K:
Tr = 773 / 647,3 = 1,2
Pr = 12 / 22,09 = 0,54
Med disse værdier placerer vi kurven svarende til T i grafen på figurenr = 1.2, angivet med en rød pil. Dernæst ser vi efter værdien af P på den vandrette akser tættere på 0,54, markeret med blåt. Nu tegner vi en lodret, indtil vi opfanger kurven Tr = 1.2 og til sidst projiceres det fra det punkt til den lodrette akse, hvor vi læser den omtrentlige værdi af Z = 0,89.
Løst øvelser
Øvelse 1
Der er en gasprøve ved en temperatur på 350 K og et tryk på 12 atmosfærer, med et molært volumen 12% større end det, der er forudsagt af den ideelle gaslov. Beregn:
a) Kompressionsfaktor Z.
b) Molvolumen gas.
c) I henhold til de tidligere resultater, angiv hvilke er de dominerende kræfter i denne gasprøve.
Data: R = 0,082 L.atm / mol.K
Løsning til
At vide, at V ægte er 12% større end Videel :
Vægte = 1,12Videel
Z = V ægte / Videel = 1,12
Løsning b
P. Vægte = Z. R. T → Vægte = (1,12 x 0,082 x 350/12) L / mol = 2,14 L / mol.
Løsning c
De frastødende kræfter er de, der dominerer, da volumenet af prøven steg.
Øvelse 2
Der er 10 mol ethan begrænset i et volumen på 4,86 l ved 27 ºC. Find det tryk, som etan udøver fra:
a) Den ideelle gasmodel
b) Van der Waals ligningen
c) Find kompressionsfaktoren fra de tidligere resultater.
Data for etan
Van der Waals-koefficienter:
a = 5.489 dm6. pengeautomat. muldvarp-to og b = 0,06380 dm3. muldvarp-1.
Kritisk tryk: 49 atm. Kritisk temperatur: 305 K
Løsning til
Temperaturen overføres til kelvin: 27 º C = 27 +273 K = 300 K, husk også, at 1 liter = 1 L = 1 dm3.
Derefter erstattes de leverede data i den ideelle gasligning:
P.V = n.R.T → P = (10 x 0,082 x 300 / 4,86 L) atm = 50,6 atm
Løsning b
Van der Waals-ligningen for staten er:
Hvor a og b er de koefficienter, der gives i udsagnet. Når du rydder P:
Løsning c
Vi beregner reduceret tryk og temperatur:
Pr = 35,2 / 49 = 0,72
Tr = 300/305 = 0,98 ≈ 1
Med disse værdier ser vi efter værdien af Z i grafen i figur 2 og finder ud af, at Z er cirka 0,7.
Referencer
- Atkins, s. 1999. Fysisk kemi. Omega-udgaver.
- Cengel, Y. 2012. Termodynamik. 7mor Udgave. Mcgraw bakke.
- Engel, T. 2007. Introduktion til fysisk-kemi: termodynamik. Pearson.
- Levine, I. 2014. Principper for fysisk-kemi. 6. Udgave. Mcgraw bakke.
- Wikipedia. Kompressibilitetsfaktor. Gendannet fra: en.wikipedia.org.

Endnu ingen kommentarer