
Fluorhistorie, egenskaber, struktur, opnåelse, risici, anvendelser
Det fluor Det er et kemisk element, der er repræsenteret ved symbolet F og hovedgruppe 17, som halogener hører til. Det skelnes over de andre elementer i det periodiske system for at være det mest reaktive og elektronegative; reagerer med næsten alle atomer, så det danner utallige salte og organfluorerede forbindelser.
Under normale forhold er det en lysegul gas, der kan forveksles med gulgrøn. I flydende tilstand, vist på billedet nedenfor, intensiveres den gule farve lidt mere, som forsvinder helt, når den størkner ved sit frysepunkt..

Sådan er dens reaktivitet på trods af gasens flygtige natur, at den forbliver fanget i jordskorpen; især i form af mineralet fluorit, kendt for sine violette krystaller. Ligeledes gør dets reaktivitet det til et potentielt farligt stof; reagerer kraftigt på alt det rører ved og brænder i flammer.
Imidlertid kan mange af dets biprodukter være harmløse og endda gavnlige afhængigt af deres anvendelser. For eksempel er den mest populære anvendelse af fluorid, tilsat i sin ioniske eller mineralske form (såsom fluoridsalte), fremstilling af fluortandpastaer, som hjælper med at beskytte tandemaljen..
Fluor har den ejendommelighed, at det kan stabilisere de høje tal eller oxidationstilstande for mange andre grundstoffer. Jo højere antallet af fluoratomer, jo mere reaktiv er forbindelsen (medmindre den er en polymer). Ligeledes vil dens virkninger med molekylære matricer øges; på godt og ondt.
Artikelindeks
- 1 Historie
- 1.1 Brug af fluorit
- 1.2 Fremstilling af flussyre
- 1.3 Isolering
- 1.4 Interesse for fluor
- 2 Fysiske og kemiske egenskaber
- 2.1 Udseende
- 2.2 Atomnummer (Z)
- 2.3 Atomvægt
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Tæthed
- 2.7 Fordampningsvarme
- 2.8 Molær varmekapacitet
- 2.9 Damptryk
- 2.10 Varmeledningsevne
- 2.11 Magnetisk rækkefølge
- 2.12 Lugt
- 2.13 oxidationstal
- 2.14 Ioniseringsenergi
- 2.15 Elektronegativitet
- 2.16 Oxiderende middel
- 2.17 Reaktivitet
- 3 Struktur og elektronisk konfiguration
- 3.1 Diatomisk molekyle
- 3.2 Flydende og fast
- 4 Hvor kan man finde og hente
- 4.1 Fluoritbehandling
- 4.2 Elektrolyse af hydrogenfluorid
- 5 isotoper
- 6 Biologisk rolle
- 7 risici
- 7.1 Tandfluorose
- 7.2 Skelettfluorose
- 8 anvendelser
- 8.1 Tandpastaer
- 8.2 Vandfluoridering
- 8.3 Oxiderende middel
- 8.4 Polymerer
- 8.5 Apotekere
- 8.6 Glasætsning
- 8.7 Berigelse af uran
- 9 Referencer
Historie
Brug af fluorit
I 1530 opdagede den tyske mineralog Georgius Agricola, at mineralet fluorspar kunne bruges til oprensning af metaller. Fluorspar er et andet navn for fluorit, et fluormineral, der bestod af calciumfluorid (CaFto).
Elementet fluor var ikke blevet opdaget dengang, og "fluoiret" i fluorit kom fra det latinske ord "fluere", hvilket betyder "at strømme"; siden dette netop var fluorspar eller fluorit med metaller: det hjalp dem med at forlade prøven.
Fremstilling af flussyre
I 1764 lykkedes Andreas Sigismud Margraff at fremstille flussyre, opvarme fluorit med svovlsyre. Glasretorterne blev smeltet af syrenes virkning, så glasset blev erstattet af metaller.
Det tilskrives også Carl Scheele i 1771, fremstillingen af syren efter samme metode efterfulgt af Margraff. I 1809 foreslog den franske videnskabsmand Andre-Marie Ampere, at fluor- eller flussyre var en forbindelse bestående af brint og et nyt element, der ligner klor..
Forskere forsøgte at isolere fluor ved at bruge flussyre i lang tid; men dets farlighed gjorde fremskridt i denne forstand vanskelig.
Humphry Davy, Joseph Louis Gay-Lussac og Jacques Thénard havde alvorlige smerter, da de inhalerede hydrogenfluorid (flussyre uden vand og i gasform). Forskere Paulin Louyet og Jerome Nickles døde af forgiftning under lignende omstændigheder.
Edmond Frémy, en fransk forsker, forsøgte at skabe tør flussyre for at undgå brintfluoridtoksicitet ved forsuring af kaliumbifluorid (KHFto), men under elektrolysen var der ingen ledning af den elektriske strøm.
Isolation
I 1860 forsøgte den engelske kemiker George Gore elektrolyse af tør flussyre og lykkedes at isolere en lille mængde fluorgas. Imidlertid opstod en eksplosion, da brint og fluor voldsomt blev rekombineret. Gore tilskrev eksplosionen en iltlækage..
I 1886 lykkedes den franske kemiker Henri Moisson at isolere fluor for første gang. Tidligere blev Moissons arbejde afbrudt fire gange af alvorlig hydrogenfluoridforgiftning, mens man forsøgte at isolere elementet..
Moisson var Frémys studerende og stolede på sine eksperimenter for at isolere fluor. Moisson brugte en blanding af kaliumfluorid og flussyre i elektrolysen. Den resulterende opløsning ledte elektricitet og fluorgas opsamlet ved anoden; det vil sige ved den positivt ladede elektrode.
Moisson brugte korrosionsbestandigt udstyr, hvor elektroderne var lavet af en legering af platin og iridium. I elektrolysen brugte han en platinbeholder og afkølede elektrolytopløsningen til en temperatur på -23 ºF (-31 ºC)..
Endelig lykkedes Henri Moissson den 26. juni 1886 at isolere fluor, et arbejde der gjorde det muligt for ham at vinde Nobelprisen i 1906.
Interesse for fluor
Interessen for fluorforskning gik tabt i en periode. Imidlertid boostede udviklingen af Manhattan-projektet til produktion af atombomben det igen.
Mellem årene 1930 og 1940 udviklede det amerikanske firma Dupont fluorerede produkter såsom klorfluorcarboner (Freon-12), der blev brugt som kølemidler; og polytetrafluorethylenplast, bedre kendt under navnet Teflon. Dette medførte en stigning i produktionen og forbruget af fluor..
I 1986, på en konference omkring et århundrede fra isoleringen af fluor, præsenterede den amerikanske kemiker Karl O. Christe en kemisk metode til fremstilling af fluor ved reaktionen mellem KtoMnF6 og SbF5.
Fysiske og kemiske egenskaber
Udseende
Fluor er en lysegul gas. I flydende tilstand er den lysegul. I mellemtiden kan det faste stof være uigennemsigtigt (alfa) eller gennemsigtigt (beta).
Atomnummer (Z)
9.
Atomvægt
18.998 u.
Smeltepunkt
-219,67 ºC.
Kogepunkt
-188.11 ºC.
Massefylde
Ved stuetemperatur: 1.696 g / L..
Ved smeltepunkt (væske): 1,505 g / ml.
Fordampningsvarme
6,51 kJ / mol.
Molær varmekapacitet
31 J / (mol K).
Damptryk
Ved en temperatur på 58 K har det et damptryk på 986,92 atm.
Varmeledningsevne
0,0277 W / (m K)
Magnetisk rækkefølge
Diamagnetisk
Lugt
Karakteristisk skarp og skarp lugt, detekterbar selv ved 20 ppb.
Oxidationsnumre
-1, der svarer til fluoranionen, F-.
Ioniseringsenergi
-Først: 1.681 kJ / mol
-Andet: 3.374 kJ / mol
-Tredje: 6.147 KJ / mol
Elektronegativitet
3.98 på Pauling-skalaen.
Det er det kemiske element med de højeste elektronegativiteter; det vil sige, den har en høj affinitet for elektronerne i de atomer, som den binder sig til. På grund af dette genererer fluoratomer store dipolmomenter i specifikke regioner i et molekyle..
Dens elektronegativitet har også en anden effekt: atomerne bundet til den mister så meget elektrondensitet, at de begynder at få en positiv ladning; dette er et positivt oxidationsnummer. Jo flere fluoratomer der er i en forbindelse, det centrale atom vil have et mere positivt oxidationsnummer..
For eksempel i OFto ilt har et oxidationsnummer på +2 (Oto+Fto-); i UF6, Uran har et oxidationsnummer på +6 (U6+F6-); det samme sker med svovl i SF6 (S6+F6-); og endelig er der AgFto, hvor sølv endda har et oxidationsnummer på +2, sjældent for det.
Derfor formår elementerne at deltage med deres mest positive oxidationstal, når de danner forbindelser med fluor..
Oxiderende middel
Fluor er det mest kraftfulde oxiderende element, så intet stof er i stand til at oxidere det; og af denne grund findes det ikke frit i naturen.
Reaktivitet
Fluor er i stand til at kombinere med alle andre grundstoffer undtagen helium, neon og argon. Det angriber heller ikke blødt stål eller kobber ved normale temperaturer. Reagerer voldsomt med organiske materialer som gummi, træ og stof.
Fluor kan reagere med ædelgas xenon for at danne den stærke oxidationsmiddel xenondifluorid, XeFto. Det reagerer også med hydrogen til dannelse af et halogenid, hydrogenfluorid, HF. Til gengæld opløses hydrogenfluorid i vand for at producere den berømte flussyre (som glas).
De sure syres surhedsgrad, klassificeret i stigende rækkefølge, er:
HF < HCl < HBr < HI
Salpetersyre reagerer med fluor til dannelse af fluornitrat, FNO3. I mellemtiden reagerer saltsyre kraftigt med fluor til dannelse af HF, OFto og ClF3.
Struktur og elektronisk konfiguration

Diatomisk molekyle

Fluoratomet i dets jordtilstand har syv valenselektroner, som er i 2s og 2p orbitaler i henhold til den elektroniske konfiguration:
[Han] 2sto 2 s5
Valensbindingsteorien (VTE) fastslår, at to fluoratomer, F, er kovalent bundet til hver komplet af sin valensoktet.
Dette sker hurtigt, fordi det kun kræver en elektron at blive isoelektronisk til neon ædlegas; og dets atomer er meget små med en meget stærk effektiv nuklear ladning, der let kræver elektroner fra miljøet.
Molekylet Fto (øverste billede), har en enkelt kovalent binding, F-F. På trods af dets stabilitet sammenlignet med frie F-atomer er det et stærkt reaktivt molekyle; homonuklear, apolar og ivrig efter elektroner. Derfor er fluor, ligesom Fto, det er en meget giftig og farlig art.
Fordi Fto er apolar, dets interaktioner afhænger af dens molekylære masse og Londons spredningskræfter. På et eller andet tidspunkt skal den elektroniske sky omkring begge F-atomer deformeres og stamme fra en øjeblikkelig dipol, der inducerer en anden i et nabomolekyle; så de tiltrækker hinanden langsomt og svagt.
Flydende og fast
Molekylet Fto den er meget lille og diffunderer relativt hurtigt i rummet. I sin gasformige fase udviser den en lysegul farve (som kan forveksles med en limegrøn). Når temperaturen falder til -188 ºC, bliver dispersionskræfterne mere effektive og gør F-molekylerneto samles nok til at definere en væske.
Flydende fluor (første billede) ser endnu mere gul ud end den respektive gas. I det er molekylerne Fto de er tættere og interagerer med lys i større grad. Interessant er, at når den forvrængede kubiske fluorkrystal dannes ved -220 ° C, falmer farven og forbliver som et gennemsigtigt fast stof..
Nu hvor F-molekylerneto er så tæt (men uden at deres molekylære rotation stopper), ser det ud til, at deres elektroner får en vis stabilitet, og derfor er deres elektroniske spring for stort til, at lyset endda interagerer med krystallen.
Krystallinske faser
Denne kubiske krystal svarer til β-fasen (den er ikke en allotrop, fordi den stadig er den samme Fto). Når temperaturen falder yderligere ned til -228 ºC, gennemgår det faste fluor en faseovergang; den kubiske krystal bliver en monoklinisk, a-fasen:
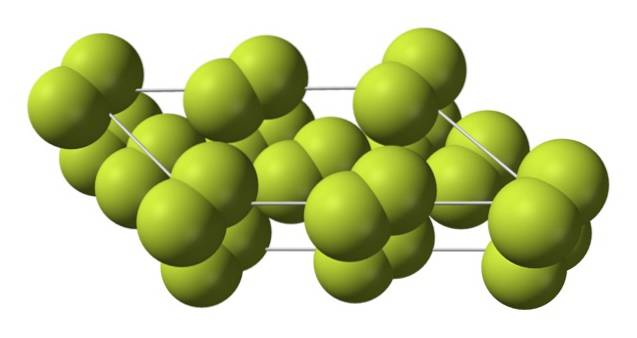
I modsætning til β-Fto, a-Fto den er uigennemsigtig og hård. Måske er det fordi F-molekylerneto de har ikke længere så meget frihed til at rotere i deres faste positioner på monokliniske krystaller; hvor de i større grad interagerer med lys, men uden at spænde deres elektroner (hvilket overfladisk ville forklare deres opacitet).
Krystalstrukturen af α-Fto det var vanskeligt at studere ved hjælp af konventionelle røntgendiffraktionsmetoder, fordi overgangen fra β til α-fasen er meget eksoterm; så krystallen eksploderede praktisk talt på samme tid, at den havde ringe interaktion med stråling.
Det tog cirka halvtreds år, før tyske forskere (Florian Kraus et al.) Fuldstændigt dechiffrerede strukturen af α-Fto mere præcist takket være neutrondiffraktionsteknikker.
Hvor kan man finde og få
Fluor rangerer 24. blandt de mest almindelige elementer i universet. Men på jorden er det masse 13vo grundstof med en koncentration på 950 ppm i jordskorpen og en koncentration på 1,3 ppm i havvand.
Jord har en fluorkoncentration mellem 150 og 400 ppm, og i nogle jordarter kan koncentrationen nå op på 1.000 ppm. I atmosfærisk luft er den til stede i en koncentration på 0,6 ppb; men det er blevet registreret i nogle byer op til 50 ppb.
Fluor opnås hovedsageligt fra tre mineraler: fluorit eller fluorospar (CaFtofluoroapatit [Ca5(PO4)3F] og kryolit (Na3AlF6).
Fluoritbehandling
Efter opsamling af klipperne med mineralet fluorit udsættes de for en primær og sekundær knusning. Ved sekundær knusning opnås meget små stenfragmenter.
Stenfragmenterne føres derefter til en kuglemølle for reduktion til pulver. Vand og reagenser tilsættes for at danne en pasta, der placeres i en flotationstank. Luft injiceres under tryk for at danne bobler, og således ender fluoritten med at flyde på den vandige overflade.
Silicater og karbonater udfældes, mens fluorit opsamles og føres til tørreovne..
Når fluoritten er opnået, omsættes den med svovlsyre til dannelse af hydrogenfluorid:
CaFto + HtoSW4 => 2 HF + CaSO4
Elektrolyse af hydrogenfluorid
Ved fremstilling af fluor følges metoden, der anvendes af Moisson i 1886, med nogle ændringer..
En elektrolyse er lavet af en blanding af smeltet kaliumfluorid og flussyre med et molforhold på 1: 2,0 til 1: 2,2. Temperaturen på det smeltede salt er 70 - 130 ºC.
Katoden består af en Monel-legering eller stål, og anoden er degrafit carbon. Fluorproduktionsprocessen under elektrolyse kan skitseres som følger:
2HF => Hto + Fto
Vand bruges til at afkøle elektrolysekammeret, men temperaturen skal være over elektrolytens smeltepunkt for at undgå størkning. Brint produceret i elektrolyse opsamles ved katoden, mens fluor ved anoden.
Isotoper
Fluor har 18 isotoper, idet de er 19F den eneste stabile isotop med 100% overflod. Det 18F har en halveringstid på 109,77 minutter og er den radioaktive isotop af fluor med den længste halveringstid. Det 18F bruges som en kilde til positroner.
Biologisk rolle
Der er ingen kendt metabolisk aktivitet af fluor i pattedyr eller højere planter. Imidlertid syntetiserer nogle planter og marine svampe monofluoracetat, en giftig forbindelse, som de bruger som en beskyttelse for at forhindre dets ødelæggelse..
Risici
Overdreven forbrug af fluor har været forbundet med knoglefluorose hos voksne og tandfluorose hos børn samt ændringer i nyrefunktionen. Af den grund foreslog USA's offentlige sundhedsvæsen (PHS), at fluorkoncentrationen i drikkevand ikke skulle være større end 0,7 mg / l.
I mellemtiden fastslog det amerikanske miljøbeskyttelsesagentur (EPA), at koncentrationen af fluor i drikkevand ikke bør være større end 4 mg / l for at undgå skeletfluorose, hvor fluor ophobes i knoglerne. Dette kan føre til svækkelse af knoglen og brud..
Fluor har været forbundet med skade på biskjoldbruskkirtlen med et fald i calcium i knoglestrukturer og høje koncentrationer af calcium i plasma.
Blandt de ændringer, der tilskrives overskydende fluor, er følgende: dental fluorose, skeletfluorose og beskadigelse af parathyroidea.
Dental fluorose
Dental fluorose opstår med små striber eller pletter i tandemaljen. Børn under 6 år bør ikke bruge fluorholdigt mundskyl..
Skelettfluorose
I skeletfluorose kan smerter og skader på knoglerne såvel som leddene diagnosticeres. Knoglen kan hærde og miste elasticitet, hvilket øger risikoen for brud.
Ansøgninger
Tandpasta

Vi begynder med afsnittet om anvendelser af fluor med det bedst kendte: det at tjene som en komponent i mange tandpastaer. Dette er ikke den eneste anvendelse, hvor kontrasten mellem dets F-molekyle værdsættesto, ekstremt giftig og farlig, og anionen F-, hvilket afhængigt af dit miljø kan være gavnligt (selvom det undertiden ikke er).
Når vi spiser mad, især slik, nedbryder bakterier det ved at øge surheden i vores spyt. Så kommer der et punkt, hvor pH er sur nok til at nedbryde og demineralisere tandemaljen; hydroxyapatit nedbrydes.
I denne proces er ionerne F- interagere med Cato+ til dannelse af en fluorapatitmatrix; mere stabil og holdbar end hydroxyapatit. Eller i det mindste er dette den foreslåede mekanisme til at forklare virkningen af fluoranion på tænderne. Det er sandsynligvis mere komplekst og har en pH-afhængig hydroxyapatit-fluorapatitbalance.
Disse anioner F- De fås i tandplanter i form af salte; såsom: NaF, SnFto (det berømte stannous fluorid) og NaPOF. Koncentrationen af F- Det skal være lavt (mindre end 0,2%), da det ellers forårsager negative virkninger på kroppen.
Vandfluoridering
I lighed med tandpasta er der tilsat fluorsalte til drikkevandskilderne for at bekæmpe hulrum hos dem, der drikker det. Koncentrationen skal stadig være meget lavere (0,7 ppm). Imidlertid er denne praksis ofte genstand for mistillid og kontrovers, da det er tilskrevet mulige kræftfremkaldende virkninger.
Oxiderende middel
Gas Fto det opfører sig som et meget stærkt oxidationsmiddel. Dette får mange forbindelser til at brænde hurtigere end når de udsættes for ilt og en varmekilde. Derfor er det blevet brugt i raketbrændstofblandinger, hvor det endda kan erstatte ozon.
Polymerer
I mange anvendelser skyldes bidragene af fluor ikke Fto eller F-, men direkte til dets elektronegative atomer som en del af en organisk forbindelse. I det væsentlige taler vi om et CF-link..
Afhængig af strukturen er polymerer eller fibre med CF-bindinger normalt hydrofobe, så de bliver ikke våde eller modstår angreb af flussyre; Eller endnu bedre, de kan være fremragende elektriske isolatorer og nyttige materialer, hvorfra genstande såsom rør og pakninger er fremstillet. Teflon og nafion er eksempler på disse fluorerede polymerer.
Apotekere
Reaktiviteten af fluor gør dens anvendelse til syntese af flere fluorforbindelser, organiske eller uorganiske, tvivlsom. I organiske stoffer øger specifikt dem med farmakologiske virkninger, at erstatte et af deres heteroatomer med F-atomer (positivt eller negativt) deres virkning på deres biologiske mål..
Derfor er modifikationen af nogle lægemidler i lægemiddelindustrien altid på bordet..
Meget ens sker med herbicider og fungicider. Fluoridet i dem kan øge deres virkning og effektivitet på insekter og svampedyr..
Glasgravering
Flussyre er på grund af sin aggressivitet med glas og keramik blevet brugt til at gravere tynde og sarte stykker af disse materialer; normalt bestemt til fremstilling af mikrocomponenter af computere eller til elektriske pærer.
Uranberigelse
En af de mest relevante anvendelser af elementært fluor er at hjælpe med at berige uran som 235U. Til dette opløses uranmineraler i flussyre, der producerer UF4. Dette uorganiske fluorid reagerer derefter med Fto, for således at transformere til UF6 (235PHEW6 Y 238PHEW6).
Efterfølgende og ved gascentrifugering, 235PHEW6 adskiller sig fra 238PHEW6 for senere at blive oxideret og opbevaret som nukleart brændsel.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Krämer Katrina. (2019). Frossen fluors struktur er genoptaget efter 50 år. Royal Society of Chemistry. Gendannet fra: chemistryworld.com
- Wikipedia. (2019). Fluor. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Fluor. PubChem-database. CID = 24524. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fakta om fluorelementer. Chemicool. Gendannet fra: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21. februar). De overraskende almindelige anvendelser af den meget reaktive fluor. Gendannet fra: sciencestruck.com
- Paola Opazo Sáez. (4. februar 2019). Fluor i tandpasta: er det godt eller dårligt for dit helbred? Gendannet fra: nacionfarma.com
- Karl Christe & Stefan Schneider. (8. maj 2019). Fluor: kemisk grundstof. Encyclopædia Britannica. Gendannet fra: britannica.com
- Lenntech B.V. (2019). Periodisk system: ilt. Gendannet fra: lenntech.com
- Gagnon Steve. (s.f.). Elementet fluor. Jefferson Lab. Gendannet fra: education.jlab.org
- American Cancer Society medicinsk og redaktionelt indholdsteam. (2015, 28. juli). Vandfluoridering og kræftrisiko. Gendannet fra: cancer.org



Endnu ingen kommentarer