
Samhørighedskraft

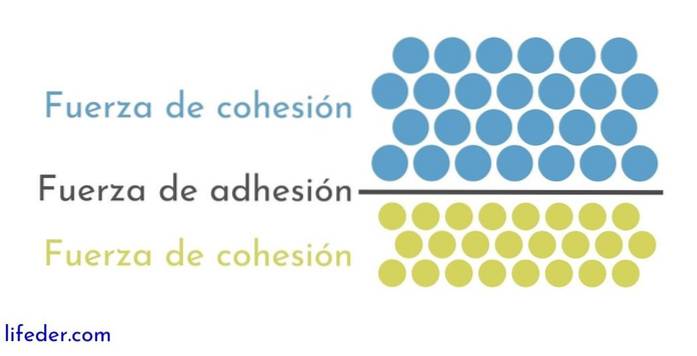
Hvad er samhørighedskræfter?
Det samhørighedskræfter de er de intermolekylære tiltrækningskræfter, der holder molekyler sammen. Afhængig af intensiteten af samhørighedskræfterne er et stof i fast, flydende eller gasformig tilstand. Værdien af samhørighedskræfterne er en iboende egenskab for hvert stof.
Denne egenskab er relateret til formen og strukturen af molekylerne i hvert stof. Et vigtigt kendetegn ved samhørighedskræfter er, at de falder hurtigt med stigende afstand. Derefter kaldes samhørighedskræfter de attraktive kræfter, der opstår mellem molekylerne af det samme stof.
Det frastødende kræfter er dem, der skyldes partiklernes kinetiske energi (energi på grund af bevægelse). Denne energi får molekylerne til at bevæge sig konstant. Intensiteten af denne bevægelse er direkte proportional med temperaturen, hvor stoffet findes..
For at forårsage ændring af et stofs tilstand er det nødvendigt at hæve temperaturen gennem transmission af varme. Dette får stoffets frastødende kræfter til at stige, hvilket i tilfældet kan ende med at antage, at tilstandsændringen finder sted..
På den anden side er det vigtigt og nødvendigt at skelne mellem samhørighed og vedhæftning:
- Samhørighed skyldes de attraktive kræfter, der opstår mellem tilstødende partikler af det samme stof.
- Adhæsion er resultatet af interaktionen, der opstår mellem overflader af forskellige stoffer eller kroppe.
Disse to kræfter ser ud til at være forbundet i forskellige fysiske fænomener, der påvirker væsker, så en god forståelse af begge er vigtig..
Samhørighedskræfter i faste stoffer, væsker og gasser

I faste stoffer
Generelt er samhørighedskræfterne i faste stoffer meget høje, og de forekommer intenst i de tre retninger af rummet..
På denne måde, hvis en ekstern kraft påføres et fast legeme, finder kun små forskydninger af molekylerne sted i forhold til hinanden..
Når den eksterne kraft forsvinder, er samhørighedskræfterne desuden stærke nok til at bringe molekylerne tilbage til deres oprindelige position og genvinde positionen inden påføring af kraften..
I væsker
Tværtimod er samhørighedskræfterne i væsker kun høje i to af de rumlige retninger, mens de er meget svage mellem væskelagene..
Når en kraft således påføres en tangential retning på en væske, bryder denne kraft de svage bindinger mellem lagene. Dette får væskelagene til at glide over hinanden..
Senere, når anvendelsen af kraften er afsluttet, har samhørighedskræfterne ikke nok kraft til at bringe molekylerne i væsken tilbage til deres oprindelige position..
Derudover reflekteres samhørighed i væsker også i overfladespænding forårsaget af en ubalanceret kraft rettet mod det indre af væsken, der virker på overflademolekylerne..
Ligeledes observeres samhørighed også, når overgangen fra den flydende tilstand til den faste tilstand finder sted på grund af virkningen af kompressionen af molekylerne i væsken..
I gasser
I gasser er samhørighedskræfterne ubetydelige. På denne måde er gasmolekylerne i konstant bevægelse, da samhørighedskræfterne i deres tilfælde ikke er i stand til at holde dem bundet sammen..
Af denne grund kan kohæsionskræfterne i gasser kun værdsættes, når flydningsprocessen finder sted, hvilket finder sted, når de gasformige molekyler komprimeres, og de attraktive kræfter er stærke nok til at producere overgangen af tilstanden..
Eksempler på samhørighedskræfter
Sammenhængende kræfter kombineres ofte med adhæsionskræfter for at give anledning til visse fysiske og kemiske fænomener.
For eksempel forklarer samhørighedskræfter sammen med adhæsionskræfter nogle af de mest almindelige fænomener, der forekommer i væsker; er tilfældet med menisken, overfladespænding og kapillaritet.
Derfor er det i tilfælde af væsker nødvendigt at skelne mellem samhørighedskræfterne, der opstår mellem molekylerne i den samme væske; og de af adhæsion, der forekommer mellem molekylerne i væsken og det faste stof.
Overfladespænding

Overfladespænding er den kraft, der opstår tangentielt og pr. Længdeenhed ved kanten af den frie overflade af en væske, der er i ligevægt. Denne kraft kontraherer overfladen af væsken.
I sidste ende opstår overfladespænding, fordi kræfterne i væskens molekyler er forskellige på væskens overflade end de på indersiden..
Menisk
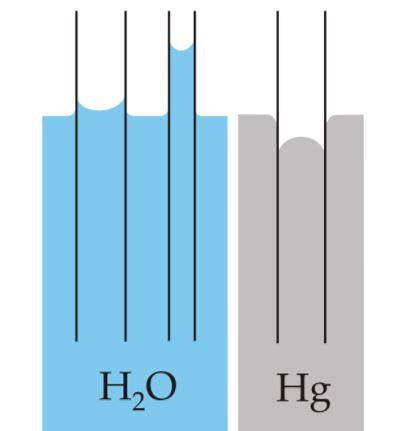
Menisk er krumningen, der dannes på overfladen af væsker, når de er indesluttet i en beholder. Denne kurve er produceret af den effekt, at overfladen af beholderen, der indeholder den, har på væsken..
Kurven kan være konveks eller konkav, afhængigt af om kraften mellem molekylerne i væsken og beholderens er attraktiv - som det er tilfældet med vand og glas - eller er frastødende som det sker mellem kviksølv og glas..
Kapillaritet

Kapillaritet er en egenskab af væsker, der giver dem mulighed for at stige op eller ned gennem et kapillarrør. Det er ejendommen, der delvis tillader stigning af vand inde i planterne.
En væske stiger op over kapillarrøret, når samhørighedskræfterne er mindre end vedhæftningskravene mellem væsken og væggene i røret. På denne måde vil væsken fortsætte med at stige, indtil værdien af overfladespændingen er lig med vægten af væsken indeholdt i kapillarrøret..
Tværtimod, hvis samhørighedskræfterne er større end vedhæftningskræfterne, vil overfladespændingen sænke væsken, og formen på dens overflade vil være konveks..
Referencer
- Samhørighed (kemi) (n.d.). I Wikipedia. Gendannet fra en.wikipedia.org.
- Overfladespænding (nd). I Wikipedia. Gendannet fra en.wikipedia.org.
- Kapillaritet (nd). I Wikipedia. Gendannet fra es.wikipedia.org.
- Ira N. Levine; "Fysisk-kemi" bind 1; Femte udgave; 2004; Mc Graw Hillm.
- Moore, John W. Stanitski, Conrad L.; Jurs, Peter C. (2005). Kemi: Molekylær Videnskab. Belmont, Californien: Brooks / Cole.
- White, Harvey E. (1948). Modern College Physics. van Nostrand.


Endnu ingen kommentarer