
Proteinglycosyleringstyper, proces og funktioner

Det proteinglycosylering Det er en post-translationel modifikation, der består af tilsætningen af lineære eller forgrenede oligosaccharidkæder til et protein. De resulterende glycoproteiner er generelt overfladeproteiner og sekretoriske proteiner..
Glykosylering er en af de mest almindelige peptidmodifikationer blandt eukaryote organismer, men det har vist sig at forekomme også i nogle arter af arkæer og bakterier..
I eukaryoter forekommer denne mekanisme mellem det endoplasmatiske reticulum (ER) og Golgi-komplekset med indblanding af forskellige enzymer involveret både i regulatoriske processer og i dannelsen af kovalente bindinger med protein + oligosaccharid..
Artikelindeks
- 1 Typer af glykolyse
- 1.1 N-glycosylering
- 1.2 O-glycosylering
- 1.3 C-mannosylering
- 1.4 Glypiering (fra engelsk "Glypiation")
- 2 Process
- 2.1 I eukaryoter
- 2.2 I prokaryoter
- 3 funktioner
- 3.1 Vigtighed
- 4 Referencer
Typer af glykolyse
Afhængigt af bindingsstedet for oligosaccharidet til proteinet kan glycosylering klassificeres i 4 typer:
N-glycosylering
Det er det mest almindelige af alle og forekommer, når oligosaccharider binder til nitrogenet i amidgruppen af asparaginrester i Asn-X-Ser / Thr-motivet, hvor X kan være en hvilken som helst aminosyre undtagen prolin.
ELLER-glycosylering
Når kulhydrater er bundet til hydroxylgruppen af serin, threonin, hydroxylysin eller tyrosin. Det er en mindre almindelig modifikation og er eksempler på proteiner såsom kollagen, glycophorin og muciner..
C-mannosilation
Den består af tilsætningen af en mannoserest, der binder til proteinet ved en C-C-binding med C2 i indolgruppen i tryptophanrester.
Glipiering (fra engelsk “Glypiering ")
Et polysaccharid fungerer som en bro til at binde et protein til et glycosylphosphatidylinositol (GPI) anker på membranen.
Behandle
I eukaryoter
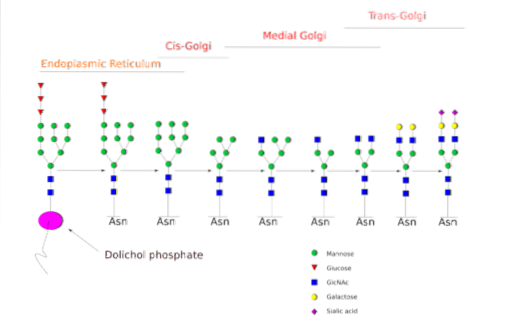
Det N-glycosylering er den, der er blevet undersøgt mere detaljeret. I pattedyrsceller begynder processen i den grove ER, hvor et præformet polysaccharid binder til proteiner, når de kommer ud af ribosomer..
Nævnte forløberpolysaccharid er sammensat af 14 sukkerrester, nemlig: 3 glucose (Glc), 9 mannose (Man) og 2 N-acetylglucosamin (GlcNAc) rester.
Denne forløber er almindelig i planter, dyr og encellede eukaryote organismer. Det er bundet til membranen takket være en binding med et dolicholmolekyle, et isoprenoid lipid indlejret i ER-membranen..
Efter syntese overføres oligosaccharidet af oligosacryltransferaseenzymkomplekset til en asparaginrest inkluderet i tri-peptidsekvensen Asn-X-Ser / Thr af et protein, mens det translateres.
De tre Glc-rester i slutningen af oligosaccharidet tjener som et signal til korrekt oligosaccharidsyntese og spaltes sammen med en af Man-resterne, før proteinet føres ind i Golgi-apparatet til yderligere behandling..
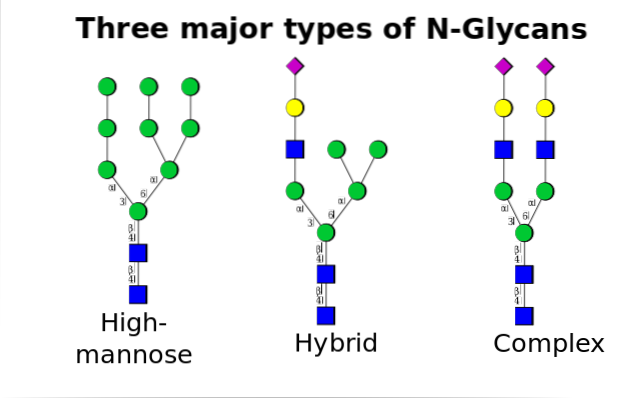
En gang i Golgi-apparatet kan oligosacchariddelene, der er bundet til glycoproteinerne, modificeres ved tilsætning af galactose, sialinsyre, fucose og mange andre rester, hvilket giver kæder med meget større variation og kompleksitet..
Det enzymatiske maskineri, der er nødvendigt for at udføre glycosyleringsprocesserne, inkluderer adskillige glycosyltransferaser til tilsætning af sukker, glycosidaser til deres fjernelse og forskellige nukleotidsukkertransportører for bidraget fra de rester, der anvendes som substrater..
I prokaryoter
Bakterier har ikke intracellulære membransystemer, så dannelsen af det oprindelige oligosaccharid (af kun 7 rester) forekommer på den cytosoliske side af plasmamembranen..
Nævnte forløber syntetiseres på et lipid, der derefter translokeres af en ATP-afhængig flipase i det periplasmatiske rum, hvor glycosylering finder sted..
En anden vigtig forskel mellem eukaryot og prokaryot glycosylering er, at enzymet oligosaccharidtransferase (oligosacaryltransferase) fra bakterier kan overføre sukkerrester til frie dele af allerede foldede proteiner, ikke som de oversættes med ribosomer..
Endvidere er peptidmotivet, der genkendes af dette enzym, ikke den samme eukaryote tri-peptidsekvens..
Funktioner
Det N-oligosaccharider bundet til glycoproteiner tjener forskellige formål. For eksempel kræver nogle proteiner denne post-translationelle modifikation for at opnå korrekt foldning af deres struktur..
For andre tilvejebringer det stabilitet, enten ved at undgå proteolytisk nedbrydning, eller fordi denne del er nødvendig for dem at udføre deres biologiske funktion..
Da oligosaccharider har en stærk hydrofil karakter, ændrer deres kovalente tilsætning til et protein nødvendigvis dets polaritet og opløselighed, hvilket kan have relevans fra et funktionelt synspunkt..
Når de er bundet til membranproteiner, er oligosaccharider værdifulde informationsbærere. De deltager i processerne med signalering, kommunikation, genkendelse, migration og celleadhæsion.
De har en vigtig rolle i blodkoagulation, heling og immunrespons såvel som i behandlingen af proteinkvalitetskontrol, som er glycanafhængig og uundværlig for cellen..
Betydning
Mindst 18 genetiske sygdomme er blevet forbundet med proteinglykosylering hos mennesker, hvoraf nogle involverer dårlig fysisk og mental udvikling, mens andre kan være dødelige.
Der er et stigende antal opdagelser relateret til glykosyleringssygdomme, især hos pædiatriske patienter. Mange af disse lidelser er medfødte og har at gøre med defekter forbundet med de indledende faser af oligosacchariddannelse eller med reguleringen af de enzymer, der deltager i disse processer..
Da en stor del af de glykosylerede proteiner udgør glycocalyxen, er der en voksende interesse i at verificere, at mutationer eller ændringer i glykosyleringsprocesserne kan være relateret til ændringen i mikromiljøet af tumorceller og således fremmer progressionen af tumorer og udvikling af metastaser hos kræftpatienter.
Referencer
- Aebi, M. (2013). N-bundet proteinglycosylering i ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M., & Warren, C. E. (1999). Proteinglycosylering i udvikling og sygdom. BioEssays, enogtyve(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Molekylær cellebiologi (5. udgave). Freeman, W. H. & Company.
- Luckey, M. (2008). Membran strukturel biologi: med biokemiske og biofysiske fundamenter. Cambridge University Press. Hentet fra www.cambrudge.org/9780521856553
- Nelson, D. L. og Cox, M. M. (2009). Lehninger Principper for biokemi. Omega-udgaver (5. udgave).
- Nothaft, H., & Szymanski, C. M. (2010). Proteinglykosylering i bakterier: Sødere end nogensinde. Naturanmeldelser Mikrobiologi, 8(11), 765-778.
- Ohtsubo, K. og Marth, J. D. (2006). Glykosylering i cellulære mekanismer for sundhed og sygdom. Celle, 126(5), 855-867.
- Spiro, R. G. (2002). Proteinglycosylering: natur, distribution, enzymatisk dannelse og sygdomsimplikationer af glykopeptidbindinger. Glykobiologi, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., & Cummings, R. D. (2015). Proteinglykosylering i kræft. Årlig gennemgang af patologi: sygdomsmekanismer, 10(1), 473-510.
- Strasser, R. (2016). Planteprotein glykosylering. Glykobiologi, 26(9), 926-939.
- Xu, C., & Ng, D. T. W. (2015). Glykosyleringsstyret kvalitetskontrol af proteinfoldning. Naturanmeldelser Molekylær cellebiologi, 16(12), 742-752.
- Zhang, X., & Wang, Y. (2016). Glykosyleringskvalitetskontrol med Golgi-strukturen. Journal of Molecular Biology, 428(16), 3183-3193.

Endnu ingen kommentarer