
Klor (III) oxidegenskaber, struktur, anvendelser
Det klor (III) oxid er en uorganisk forbindelse, hvis kemiske formel er CltoELLER3. Svarer til klorsyreanhydrid, HClOto. Det er et mørkebrunt fast stof, meget eksplosivt selv ved temperaturer under 0 ° C og dårligt karakteriseret. Derfor er det et objekt af interesse for beregningsstudier..
Kemisk er det et kovalent oxid, så der er Cl-O-bindinger og et diskret Cl-molekyletoELLER3 (nederste billede). Et sådant molekyle kan godt dannes ved dehydrering af HClOto, eller udsættes for fotolyse ved lave temperaturer. Detaljen er, at den nedbrydes og producerer Clto, ELLERto, eller andre termodynamisk stabile chloroxider.
Da Cl-O-bindinger er dårligt polære, er Cl-molekylettoELLER3 har et lille dipolmoment; derfor opløses det ikke godt i vand eller interagerer med andre polære opløsningsmidler. Dens ustabilitet er sådan, at den ikke er kendt for kommercielle eller potentielle anvendelser (og dens anvendelighed ville heller ikke være levedygtig som et eksplosivt stof).
Hovedårsagen til dets ustabilitet kan skyldes de elektroniske egenskaber ved den formodede Cl3+ (forudsat en rent ionisk karakter). Faktisk er dets oxidationstilstande +1 og +5 de mest stabile, når klor danner forbindelser med ilt..
Artikelindeks
- 1 egenskaber
- 2 Struktur af klor (III) oxid
- 2.1 Isomerer
- 3 Nomenklatur
- 4 anvendelser
- 5 Referencer
Ejendomme
Da karakteriseringen er dårlig og dårligt dokumenteret, er der ikke meget at sige om dens egenskaber undtagen følgende punkter:
-Det har en molekylvægt på 118.903.
-Det er en solid mørkebrun; skønt det kan sublimere gasformigt klor og afgive gulgrønne dampe.
-Det mangler både et kogepunkt og et smeltepunkt, da det ved 0 ° C eksploderer (og ved koldere temperaturer også).
-Dens opløselighed i vand anslås til at være omkring 3,42 g / 100 ml, hvilket beviser, at det er et kovalent molekyle med lav polaritet..
-Reagerer med vand (det lille, der opløses) for at blive HClOto:
CltoELLER3 + HtoELLER <=> 2HClOto
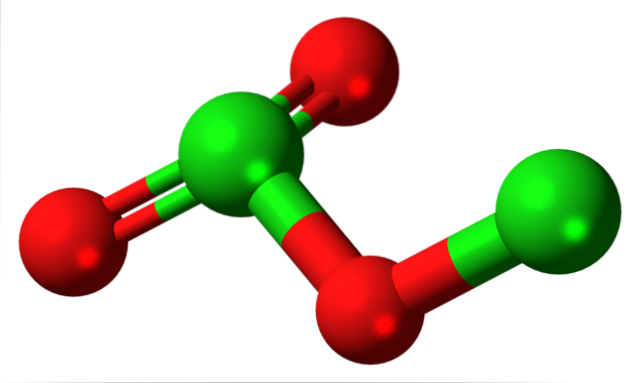
Struktur af klor (III) oxid
Billedet viste den molekylære struktur af CltoELLER3 med en model af kugler og stænger. Selvom det måske ikke ser ud som det ved første øjekast, er de usagte konsekvenser af dine links og rumlige arrangementer mere komplicerede, end de ser ud. Denne struktur svarer til en af de mange mulige isomerer for denne forbindelse..
De røde kugler svarer til iltatomer, og de grønne kugler til kloratomer. Kloren til venstre har en trigonal pyramidegeometri med et par frie elektroner; så det kan antages, at deres hybridisering skal være sp3. Et iltatom fungerer som en bro mellem de to klorer, Cl-O-Cl.
Isomerer
Hvad er de andre isomerer? I teorien beregnes ni, hvoraf fire er de mest stabile (inklusive den i billedet). De andre tre ville have strukturer som:
-ClClO3. Meget lig den forklarede, men med en Cl-Cl-obligation.
-ClOOOCl (1). I denne isomer er der en bro med tre oxygener, der adskiller de to kloratomer (husk vinkelgeometrien af HtoEller for at visualisere det).
-ClOOOCl (2). Den samme iltede bro er også til stede i denne isomer, med undtagelse af at de to kloratomer er formørket i rummet; den modsatte af den anden, mens de i ovenstående isomer er fjerne.
Nomenklatur
Dets navn, kloroxid (III), svarer til det, der er tildelt i henhold til lagernomenklaturen. Her antages det, at klor har en oxidationstilstand på +3; men det betyder ikke, at Cl-kationen3+ kan være til stede. Det er et molekyle, ikke et netværk af ioner.
Et andet navn, hvor Cl også er kendttoELLER3 er dichlortrioxid i henhold til den systematiske nomenklatur.
Og endelig, ikke så almindeligt (på trods af at den er underlagt den traditionelle nomenklatur), er der navnet kloranhydrid, der henviser til denne forbindelse. Dette navn skyldes, at Cl. Som allerede forklarettoELLER3 opstår, når HC1to kondenserer frigivelse af vand.
Ansøgninger
Da det er et kloroxid, kan den mest øjeblikkelige anvendelse, der kunne overvejes for CltoELLER3 Det er som et oxidationsmiddel, der er i stand til at neutralisere organiske urenheder og mikrober. Det er dog meget ustabilt såvel som eksplosivt, så det anses ikke engang for nyttigt til dette formål..
Der er helt sikkert ingen oplysninger om, hvordan Cl ville opføre sig.toELLER3 under enormt pres (hvis det ikke eksploderer i processen). Under normale forhold ser det ud til at være intet andet end et relativt stabilt og differentierbart mellemprodukt mellem andre mere stabile kloroxider..
Beregningsmæssigt har det dog været genstand for undersøgelse at bestemme mekanismer for frie radikaler, der involverer forskellige arter af klor og ilt..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Dichlortrioxid. Gendannet fra: en.wikipedia.org
- Dale L. Perry. (2011). Håndbog med uorganiske forbindelser. (anden version). CRC Press Taylor & Francis Group.
- Richard C. Ropp. (2013). Encyclopædi af de alkaliske jordforbindelser. Elsevier.
- Kim K. H., Han Y.K. og Lee Y. S. (1999). Basissæteffekter på Cl2O3-isomerernes stabilitet ved anvendelse af B3P86- og B3LYP-metoder til densitetsfunktionel teori. Journal of Molecular Structure THEOCHEM 460 (1-3): 19-25.



Endnu ingen kommentarer