
Carbonylgruppekarakteristika, egenskaber, nomenklatur, reaktivitet
Det carbonylgruppe Det er en organisk og iltet funktionel gruppe, der ligner det gasformige kuliltemolekyle. Det er repræsenteret som C = O, og selvom det betragtes som organisk, kan det også findes i uorganiske forbindelser; som kulsyre, HtoCO3, eller i organometalliske forbindelser med CO som et bindemiddel.
Det er dog inden for kulstof, liv, biokemi og andre lignende videnskabelige grene, hvor denne gruppe skiller sig ud for sin enorme betydning. Hvis det ikke var for ham, ville mange molekyler ikke være i stand til at interagere med vand; proteiner, sukker, aminosyrer, fedtstoffer, nukleinsyrer og andre biomolekyler ville ikke eksistere, hvis det ikke var for ham.
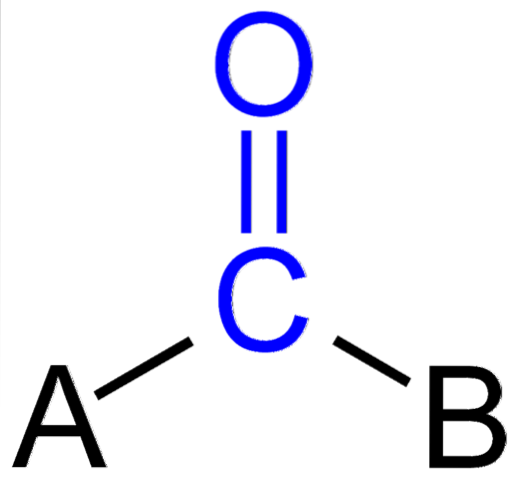
Ovenstående billede viser, hvordan denne gruppe ser ud i det generelle skelet af en forbindelse. Bemærk, at det er fremhævet med den blå farve, og hvis vi fjernede substituenterne A og B (R eller R ', lige så gyldige), ville et carbonmonoxidmolekyle forblive. Tilstedeværelsen af disse substituenter definerer et stort antal organiske molekyler.
Hvis A og B er andre atomer end carbon, såsom metaller eller ikke-metalliske grundstoffer, kan man have henholdsvis organometalliske eller uorganiske forbindelser. I tilfælde af organisk kemi vil substituenterne A og B altid være enten hydrogenatomer, carbonkæder, linjer med eller uden forgreninger, cykliske eller aromatiske ringe..
Sådan begynder det at forstå, hvorfor carbonylgruppen er ret almindelig for dem, der studerer natur- eller sundhedsvidenskab; det er overalt, og uden det ville de molekylære mekanismer, der sker i vores celler, ikke forekomme.
Hvis dets relevans kunne sammenfattes, ville det siges, at det bidrager med polaritet, surhed og reaktivitet til et molekyle. Hvor der er en carbonylgruppe, er det mere end sandsynligt, at molekylet netop på det tidspunkt kan gennemgå en transformation. Derfor er det et strategisk sted at udvikle organisk syntese gennem oxidation eller nukleofile angreb..
Artikelindeks
- 1 Karakteristika og egenskaber ved carbonylgruppen
- 1.1 Resonansstrukturer
- 2 Nomenklatur
- 3 Reaktivitet
- 3.1 Nukleofilt angreb
- 3.2 Reduktion
- 3.3 Dannelse af acetaler og ketaler
- 4 typer
- 5 Sådan identificeres det i aldehyder og ketoner
- 5.1 Identifikation
- 6 Hovedeksempler
- 7 Referencer
Karakteristika og egenskaber ved carbonylgruppen
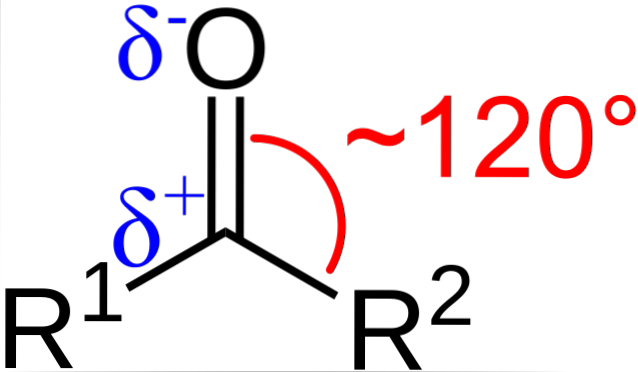
Hvad er de strukturelle og elektroniske egenskaber ved carbonylgruppen? Ovenstående kan ses, nu ved hjælp af bogstaverne R1 og Rto i stedet for A og B er der en vinkel på 120 ° C mellem substituenterne og oxygenatomet; det vil sige geometrien omkring denne gruppe er et trigonal plan.
For at en sådan geometri skal være kulstof- og iltatomerne, skal de nødvendigvis have sp kemisk hybridiseringto; således vil kulstof have tre sp orbitalerto til dannelse af enkle kovalente bindinger med R1 og Rto, og en orbital s ren for at etablere dobbeltbinding med ilt.
Dette forklarer, hvordan der kan være en C = O dobbeltbinding.
Hvis billedet observeres, vil det også ses, at ilt har en højere elektrondensitet, δ-, end kulstof, δ +. Dette skyldes det faktum, at ilt er mere elektronegativt end kulstof og derfor "frarøver" det elektrondensitet; og ikke kun ham, men også R-substituenterne1 og Rto.
Derfor genereres et permanent dipolmoment, som kan være af større eller mindre størrelse afhængigt af den molekylære struktur. Uanset hvor der er en carbonylgruppe, vil der være dipolmomenter.
Resonansstrukturer
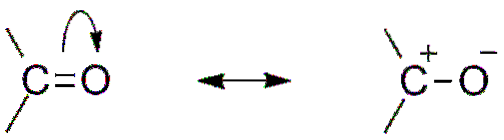
En anden konsekvens af iltens elektronegativitet er, at der i carbonylgruppen er resonansstrukturer, der definerer en hybrid (kombinationen af de to strukturer i det øverste billede). Bemærk, at elektronparret kan migrere mod orbitalen s ilt, som efterlader kulstofatomet med en positiv delvis ladning; en carbocation.
Begge strukturer efterfølger konstant hinanden, så kulstof opretholder en konstant mangel på elektroner; for kationer, der er meget tæt på det, vil de opleve elektrostatisk frastødning. Men hvis det er en anion eller en art, der er i stand til at donere elektroner, vil du føle en stærk attraktion for dette kulstof..
Derefter sker det, der kaldes det nukleofile angreb, hvilket vil blive forklaret i et fremtidigt afsnit.
Nomenklatur
Når en forbindelse har gruppen C = O, siges det at være carbonyl. Afhængig af arten af carbonylforbindelsen har den således sine egne nomenklaturregler.
Selvom de uanset hvad det er, alle deler en fælles regel: C = O har prioritet i kulstofkæden, når de angiver kulstofatomer.
Dette betyder, at hvis der er forgreninger, halogenatomer, nitrogenholdige funktionelle grupper, dobbelt- eller tredobbeltbindinger, kan ingen af dem have et lokaliseringsnummer mindre end C = O; derfor begynder den længste kæde at blive talt så tæt som muligt på carbonylgruppen.
Hvis der på den anden side er flere C = O'er i kæden, og en af dem er en del af en højere funktionel gruppe, vil carbonylgruppen have en større lokalisator og vil blive nævnt som en oxosubstituent..
Og hvad er dette hierarki? Følgende, fra højeste til laveste:
-Carboxylsyrer, RCOOH
-Ester, RCOOR '
-Amida, RCONHto
-Aldehyd, RCOH (eller RCHO)
-Keton, RCOR
Ved at erstatte R og R 'for molekylære segmenter har et utal af carbonylforbindelser stammer fra familierne ovenfor: carboxylsyrer, estere, amider osv. Hver enkelt har sin traditionelle eller IUPAC-nomenklatur tilknyttet..
Reaktivitet
Nukleofilt angreb
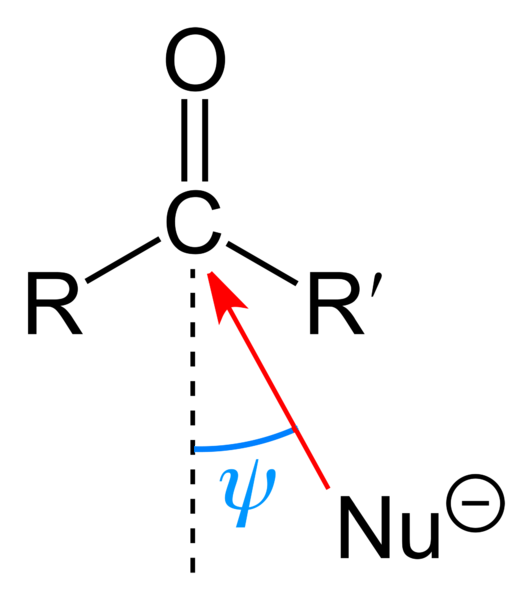
Det øverste billede viser det nukleofile angreb, som carbonylgruppen har lidt. Nukleofilen, Nu-, det kan være en anion eller en neutral art med tilgængelige elektronpar; som ammoniak, NH3, for eksempel. Det ser udelukkende efter kulstof, fordi det ifølge resonansstrukturer har en positiv delvis ladning.
Positiv ladning tiltrækker Nu-, som vil søge at tilnærme sig ved en "flanke", således at der er den mindst steriske hindring fra R- og R'-substituenterne. Afhængig af hvor omfangsrige de er eller størrelsen på Nu-, angrebet vil forekomme i forskellige vinkler ψ; kan være meget åben eller lukket.
Når angrebet sker, dannes der en mellemforbindelse, Nu-CRR'-O-; det vil sige, at der efterlades ilt med et par elektroner, så Nu kan tilføjes- carbonylgruppe.
Dette negativt ladede ilt kan gribe ind i andre reaktionstrin; protoneret som en hydroxylgruppe, OH eller frigivet som et vandmolekyle.
De involverede mekanismer såvel som reaktionsprodukterne opnået ved dette angreb er meget forskellige..
Derivater
Det nukleofile middel Nu- det kan være mange arter. For hver enkelt specifikt stammer forskellige derivater fra reaktion med carbonylgruppen.
F.eks. Når det nukleofile middel er en amin, NHtoR, imines stammer, RtoC = NR; hvis det er hydroxylamin, NHtoOH, giver anledning til oximer, RR'C = NOH; hvis det er cyanidanionen, CN-, der produceres cyanohydriner, RR'C (OH) CN og så videre med andre arter.
Reduktion
Først blev det sagt, at denne gruppe er iltet og derfor oxideret. Dette betyder, at det i betragtning af betingelserne kan reduceres eller miste bindinger med oxygenatomet ved at erstatte det med hydrogener. For eksempel:
C = O => CHto
Denne transformation indikerer, at carbonylgruppen blev reduceret til en methylengruppe; der var en stigning i brint som følge af tab af ilt. I mere passende kemiske termer: carbonylforbindelsen reduceres til en alkan.
Hvis det er en keton, RCOR ', i nærværelse af hydrazin, H.toN-NHto, og et stærkt basisk medium kan reduceres til dets respektive alkan; Denne reaktion er kendt som Wolff-Kishner reduktion:
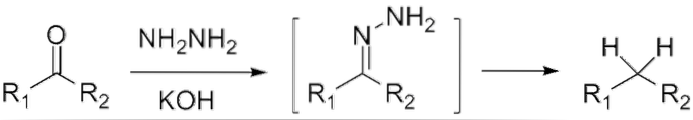
Hvis reaktionsblandingen derimod består af sammensmeltet zink og saltsyre, er reaktionen kendt som Clemmensen-reduktion:
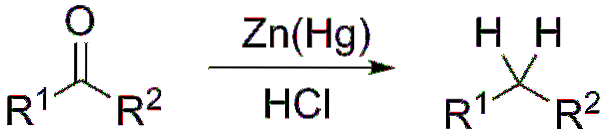
Dannelse af acetaler og ketaler
Carbonylgruppen kan ikke kun tilføje nukleofile midler Nu-, men under sure forhold kan det også reagere med alkoholer gennem lignende mekanismer.
Når et aldehyd eller keton delvis reagerer med en alkohol, dannes der henholdsvis hemiacetaler eller hemicetaler. Hvis reaktionen er afsluttet, er produkterne acetaler og ketaler. Følgende kemiske ligninger opsummerer og præciserer, hvad der netop er blevet nævnt:
RCHO + R3OH g RCHOH (OR3(Hemiacetal) + R4OH g RCH (OR3) (ELLER4) (Acetal)
RCORto + R3OH g RCORto(OH) (ELLER3) (Hemiketal) + R4OH g RCORto(ELLER3) (ELLER4) (ketal)
Den første reaktion svarer til dannelsen af hemiacetaler og acetaler fra et aldehyd, og den anden af hemicetaler og ketaler fra en keton.
Disse ligninger er muligvis ikke enkle nok til at forklare dannelsen af disse forbindelser; For en første tilgang til emnet er det imidlertid nok at forstå, at der tilsættes alkoholer, og at deres sidekæder R (R3 og R4) bliver bundet til carbonylcarbon. Derfor tilføjes OR3 og OR4 til det oprindelige molekyle.
Hovedforskellen mellem en acetal og en ketal er tilstedeværelsen af et hydrogenatom bundet til kulstoffet. Bemærk, at ketonen mangler dette brint.
Typer
Meget ens som forklaret i nomenklaturafsnittet for carbonylgruppen, hvis typer er en funktion, som er substituenterne A og B eller R og R '. Derfor er der strukturelle egenskaber, der deler en række carbonylforbindelser ud over blot rækkefølgen eller typen af bindinger..
For eksempel blev der nævnt i begyndelsen af analogien mellem denne gruppe og carbonmonoxid, C20. Hvis molekylet er blottet for hydrogenatomer, og hvis der også er to terminale C = O, vil det være et carbonoxid, CnELLERto. For n lig med 3 har vi:
O = C = C = C = O
Hvilket er som om der var to C20-molekyler forbundet og adskilt af et kulstof.
Carbonylforbindelser kan ikke kun stamme fra CO-gas, men også fra kulsyre, HtoCO3 eller OH- (C = O) -OH. Her repræsenterer de to OH R og R ', og når man erstatter en af dem eller deres hydrogener, opnås derivater af kulsyre.
Og så er der derivaterne af carboxylsyrer, RCOOH, opnået ved at ændre identiteten af R eller erstatte H med et andet atom eller kæde R '(hvilket ville give anledning til en ester, RCOOR').
Sådan identificeres det i aldehyder og ketoner
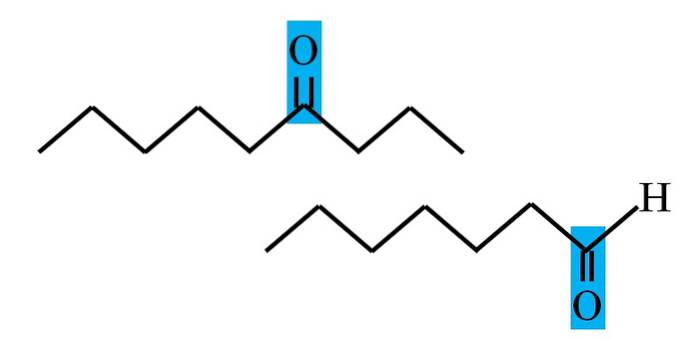
Både aldehyder og ketoner har tilstedeværelsen af carbonylgruppen til fælles. Dets kemiske og fysiske egenskaber skyldes det. Imidlertid er deres molekylære miljøer ikke de samme i begge forbindelser; i førstnævnte er den i en terminal position og i sidstnævnte hvor som helst i kæden.
For eksempel er carbonylgruppen i billedet ovenfor inde i en blå boks. I ketoner skal der ved siden af dette felt være et andet carbon- eller kædesegment (øverst); mens der i aldehyder kun kan være et hydrogenatom (bund).
Hvis C = O er i den ene ende af kæden, vil det være et aldehyd; det er den mest direkte måde at skelne den fra en keton.
ID
Men hvordan ved du eksperimentelt, om en ukendt forbindelse er et aldehyd eller en keton? Der er adskillige metoder fra spektroskopisk (absorption af infrarød stråling, IR) eller kvalitative organiske tests.
Med hensyn til kvalitative tests er disse baseret på reaktioner, hvor analytikeren, når den er positiv, vil se et fysisk svar; en ændring i farve, frigivelse af varme, dannelse af bobler osv..
For eksempel når der tilsættes en syreopløsning af KtoCrtoELLER7 aldehydet skifter til carboxylsyre, hvilket får opløsningens farve til at skifte fra orange til grøn (positiv test). I mellemtiden reagerer ketonerne ikke, og analytikeren observerer derfor ingen farveændring (negativ test).
En anden test består af anvendelse af Tollens-reagenset [Ag (NH3)to]+, for at aldehydet reducerer Ag-kationer+ til metallisk sølv. Og resultatet: dannelsen af et sølvspejl i bunden af reagensglas, hvor prøven blev placeret..
Hovedeksempler
Endelig vil en række eksempler på carbonylforbindelser blive anført:
-CH3COOH, eddikesyre
-HCOOH, myresyre
-CH3Bil3, propanon
-CH3BiltoCH3, 2-butanon
-C6H5Bil3, acetophenon
-CH3CHO, ethanal
-CH3CHtoCHtoCHtoCHO, pentanal
-C6H5CHO, benzaldehyd
-CH3CONHto, acetamid
-CH3CHtoCHtoCOOCH3, propylacetat
Hvis der nu nævnes eksempler på forbindelser, der simpelthen besidder denne gruppe, ville listen blive næsten uendelig.
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Reid Danielle. (2019). Carbonyl Group: Egenskaber og oversigt. Undersøgelse. Gendannet fra: study.com
- Sharleen Agvateesiri. (5. juni 2019). Carbonyl-gruppen. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Wiki Kids Ltd. (2018). Carbonylforbindelser. Gendannet fra: simpelthen.videnskab
- Toppr. (s.f.). Nomenklatur og struktur for Carbonyl Group. Gendannet fra: toppr.com
- Clark J. (2015). Oxidation af aldehyder og ketoner. Gendannet fra: chemguide.co.uk



Endnu ingen kommentarer