
Helium historie, egenskaber, struktur, risici, anvendelser
Det helium er et kemisk element, hvis symbol er han. Det er den første ædelgas i det periodiske system, og den er normalt placeret yderst til højre for den. Under normale forhold er det en inaktiv gas, da ingen af dens få forbindelser er stabile; Det udvides også meget hurtigt og er det stof med det laveste kogepunkt af alle.
På et populært niveau er det en velkendt gas, da det i utallige begivenheder eller børnefester er almindeligt at være vidne til, hvordan en ballon stiger, indtil den går tabt på himlen. Men hvad der virkelig og for evigt er tabt i hjørnerne af solsystemet og derover, er heliumatomer, der frigøres, når ballonen eksploderer eller tømmes..

Faktisk er der dem, der med god grund finder, at heliumballoner udgør en upassende praksis for denne gas. Heldigvis har den vigtigere og mere interessante anvendelser takket være dens fysiske og kemiske egenskaber, der adskiller den fra andre kemiske elementer..
For eksempel er flydende helium så koldt, at det kan fryse alt som en metallegering og omdanne det til et superledende materiale. Ligeledes er det en væske, der manifesterer sig overflødig, i stand til at klatre op ad væggene i en glasbeholder..
Navnet skyldes, at det blev identificeret for første gang på solen og ikke på jorden. Det er det næstmest forekommende element i hele universet, og selvom dets koncentration er ubetydelig i jordskorpen, kan den opnås fra reserverne af naturgas og radioaktive mineraler af uran og thorium..
Her demonstrerer helium en anden nysgerrig kendsgerning: det er en gas, der er meget mere rigelig i undergrunden end i atmosfæren, hvor den ender med at flygte fra jorden og dens tyngdefelt.
Artikelindeks
- 1 Historie
- 2 Fysiske og kemiske egenskaber
- 2.1 Udseende
- 2.2 Atomnummer (Z)
- 2.3 Molær masse
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Tæthed
- 2.7 tredobbelt punkt
- 2.8 Kritisk punkt
- 2.9 Fusionsvarme
- 2.10 Fordampningsvarme
- 2.11 Molær varmekapacitet
- 2.12 Damptryk
- 2.13 Ioniseringsenergier
- 2.14 Opløselighed
- 2.15 Reaktivitet
- 2.16 oxidationsnummer
- 3 Struktur og elektronisk konfiguration
- 3.1 Dimere
- 3.2 Helium II
- 3.3 Krystaller
- 4 Hvor kan man finde og hente
- 4.1 Kosmos og klipper
- 4.2 Luft og hav
- 4.3 Flydning og destillation af naturgas
- 5 isotoper
- 6 risici
- 7 anvendelser
- 7.1 Tryk- og udluftningssystemer
- 7.2 Lækagedetektioner
- 7.3 Transportgas
- 7.4 Balloner og blimps
- 7.5 Dykning
- 7.6 Buesvejsning
- 7.7 Superledere
- 8 Referencer
Historie
Helium blev ikke opdaget på Jorden, men på Solen. Navnet stammer faktisk fra det græske ord 'helios', som betyder sol. Elementets eksistens i sig selv stod i kontrast til Dmitri Mendeleevs periodiske system, da der ikke var plads i det til en ny gas; det vil sige, at der intet blev mistanke om ædelgasser.
Navnet 'helium', skrevet som 'helium' på engelsk, sluttede med, at suffikset -ium henviste til det som et metal; netop fordi eksistensen af en anden gas end ilt, brint, fluor, klor og nitrogen ikke kunne tillades.
Dette navn blev udpeget af den engelske astronom Norman Lockyer, der studerede fra England, hvad der blev observeret af den franske astronom Jules Janssen i Indien under en solformørkelse i 1868.
Det var en gul spektral linje med et hidtil ukendt element. Lockyer hævdede, at dette skyldtes tilstedeværelsen af et nyt kemisk grundstof fundet i solen.
I 1895, næsten tyve år senere, genkendte den skotske kemiker Sir William Ramsay det samme spektrum fra en restgas, da han studerede et radioaktivt mineral: cleveite. Så der var helium også her på Jorden.
Fysiske og kemiske egenskaber
Udseende
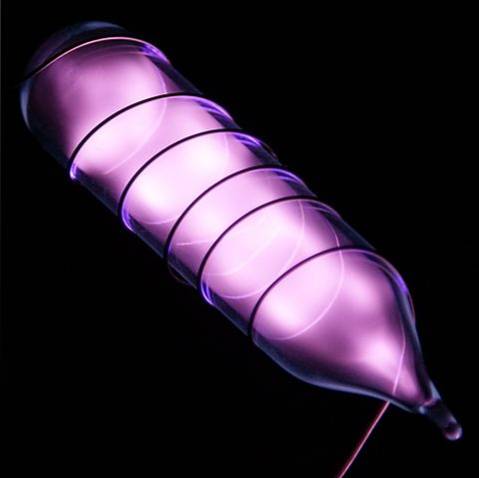
Helium er en farveløs, lugtfri gas, der ikke har nogen smag og også er inaktiv. Når der imidlertid anvendes et elektrisk stød, og afhængigt af spændingsforskellen, begynder det at lyse som en grålig-lilla tåge (billedet ovenfor) og derefter lyse med en orange glød. Derfor er heliumlysene orange.
Atomnummer (Z)
to
Molar masse
4,002 g / mol
Smeltepunkt
-272,2 ºC
Kogepunkt
-268,92 ºC
Massefylde
-0,1786 g / L under normale forhold, dvs. i gasfasen.
-0,155 g / ml ved smeltepunkt flydende helium.
-0,125 g / ml, ligesom helium begynder at koge.
-0,187 g / ml ved 0 K og 25 atm, dvs. fast helium ved de specifikke tryk- og temperaturbetingelser.
Triple point
2.177 K og 5.043 kPa (0,04935 atm)
Kritisk punkt
5.1953 K og 0.22746 MPa (2.2448 atm)
Fusionsvarme
0,0138 kJ / mol
Fordampningsvarme
0,0829 kJ / mol
Molær varmekapacitet
20,78 J / (mol K)
Damptryk
0,969 atm ved 4,21 K. Denne værdi giver dig en idé om, hvor flygtigt helium kan være, og hvor let det kan slippe ud ved stuetemperatur (tæt på 298 K).
Ioniseringsenergier
-Først: 2372,3 kJ / mol (He+ gasformig)
-Andet: 5250,5 kJ / mol (Heto+ gasformig)
Ioniseringsenergierne for helium er især høje, fordi det gasformige atom skal miste en elektron, der oplever en stærk effektiv nuklear ladning. Det kan også forstås ved at overveje atomets lille størrelse og hvor "tæt" de to elektroner er på kernen (med dens to protoner og to neutroner).
Opløselighed
I vand opløses 0,97 ml for hver 100 ml vand ved 0 ºC, hvilket betyder, at det er dårligt opløseligt.
Reaktivitet
Helium er det næstmest reaktive kemiske element i naturen. Under normale forhold er det korrekt at sige, at det er en inaktiv gas; Aldrig (ser det ud til) kan en heliumforbindelse manipuleres i et rum eller laboratorium uden enorme tryk, der virker på det; eller måske dramatisk høje eller lave temperaturer.
Et eksempel, vi ser i forbindelsen NatoHan, som kun er stabil under et tryk på 300 GPa, gengivet i en diamantamboltcelle.
Mens de kemiske bindinger i NatoDe er "mærkelige" med deres elektroner godt placeret i krystallerne, de er langt fra at være enkle Van der Walls-interaktioner, og derfor består de ikke bare af heliumatomer fanget af molekylære aggregater. Det er her dilemmaet opstår mellem hvilke heliumforbindelser der er reelle og hvilke der ikke er..
For eksempel kan nitrogenmolekyler ved høje tryk fange et heliumatom til dannelse af en slags clathrat, He (Nto)elleve.
Ligeledes er der de endohedrale komplekser af fullerenkationer, C60+n og C70+n, i hvis hulrum de kan rumme heliumatomer; og den molekylære kation HeH+ (He-H+), findes i meget fjerne tåger.
Oxidationsnummer
Hvem af nysgerrighed forsøger at beregne oxidationsnummeret for helium i nogen af dets forbindelser, finder ud af, at dette er lig med 0. I NatoHan kunne for eksempel tænkes, at dens formel svarer til hypotetiske Na-ionerto+jeg harto-; men sådan ville være at antage, at det har en ren ionisk karakter, når dens bånd i virkeligheden langt fra er det.
Desuden får helium ikke elektroner, fordi det ikke kan rumme dem i 2'ers orbital, energisk utilgængelig; Det er heller ikke muligt for det at miste dem på grund af dets lille størrelse og den store effektive nukleare ladning i dens kerne. Derfor deltager helium altid (i teorien) som et atom He0 i dets afledte forbindelser.
Struktur og elektronisk konfiguration
Helium optager, ligesom alle gasser, der observeres i makroskala, volumenet af beholderne, der opbevarer det, og har således en ubestemt form. Men når temperaturen falder og begynder at køle ned til -269 ºC, kondenserer gassen til en farveløs væske; helium I, den første af de to flydende faser for dette element.
Grunden til, at helium kondenserer ved en så lav temperatur, skyldes de lave spredningskræfter, der holder dets atomer sammen; uanset hvilken fase der overvejes. Dette kan forklares ud fra dens elektroniske konfiguration:
1sto
I hvilke to elektroner optager 1s atombane. Heliumatomet kan visualiseres som en næsten perfekt sfære, hvis homogene elektroniske periferi er lidt tilbøjelig til polarisering af den effektive nukleare ladning af de to protoner i kernen..
Således er spontane og inducerede dipolmomenter sjældne og meget svage; så temperaturen skal nærme sig absolut nul, så He-atomerne nærmer sig langsomt nok og opnår, at deres spredningskræfter definerer en væske; eller endnu bedre, en heliumkrystal.
Dimers
I gasfasen er det rum, der adskiller He-atomerne, sådan at det kan antages, at de altid er adskilt fra hinanden. Så meget, at helium i et hætteglas med lille volumen ser farveløst ud, indtil det udsættes for en elektrisk afladning, som ioniserer dets atomer i en grålig og ikke særlig lys tåge..
Imidlertid kan atomerne i den flydende fase, selv med deres svage interaktioner, ikke længere "ignoreres". Nu giver dispersionskraften dem mulighed for kortvarigt at gå sammen for at danne dimerer: Han-han eller hanto. Derfor kan helium jeg betragtes som store klynger af Hanto i ligevægt med dets atomer i dampfasen.
Derfor er helium I så vanskeligt at skelne fra dets dampe. Hvis denne væske spildes ud af den lufttætte beholder, slipper den ud som en hvidlig blusser..
Helium II
Når temperaturen falder endnu mere ved at berøre 2.178 K (-270.972 ºC), sker der en faseovergang: helium I omdannes til helium II.
Fra dette tidspunkt bliver den allerede fascinerende heliumvæske en superfluid eller kvantevæske; det vil sige, deres makroskopiske egenskaber manifesteres som om dimererne Heto de var individuelle atomer (og måske er de). Det mangler fuldstændig viskositet, da der ikke er nogen overflade, der kan stoppe et atom under dets glidning eller "klatring".
Derfor kan helium II bestige væggene i en glasbeholder, der overvinder tyngdekraften; uanset hvor høje de er, så længe overfladen forbliver ved den samme temperatur og derfor ikke fordamper.
På grund af dette kan flydende helium ikke opbevares i glasbeholdere, da det vil undslippe ved den mindste revne eller hul; meget lig hvordan det ville ske med en gas. I stedet bruges rustfrit stål til at designe sådanne beholdere (Dewars-tanke).
Krystaller
Selvom temperaturen faldt til 0 K (absolut nul), ville spredningskraften mellem He-atomerne ikke være stærk nok til at ordne dem i en krystallinsk struktur. For at størkning kan forekomme, skal trykket stige til ca. 25 atm; og derefter vises kompakte sekskantede heliumkrystaller (hcp).
Geofysiske undersøgelser viser, at denne hcp-struktur forbliver uændret, uanset hvor meget tryk stiger (op til størrelsen af gigapascal, GPa). Der er dog et snævert område i deres tryk-temperatur-diagram, hvor disse hcp-krystaller gennemgår en overgang til en kropscentreret kubisk fase (bcc)..
Hvor kan man finde og få
Kosmos og klipper

Helium er det næstmest forekommende element i hele universet, andet efter brint. Stjerner producerer konstant umålelige mængder af heliumatomer gennem fusion af to hydrogenkerner under nukleosyntese-processen..
Ligeledes er enhver radioaktiv proces, der udsender α-partikler, en kilde til produktion af heliumatomer, hvis de interagerer med elektronerne i miljøet; for eksempel med dem fra en stenet krop i aflejringer af radioaktive mineraler af uran og thorium. Disse to elementer gennemgår radioaktivt henfald, der starter med uran:
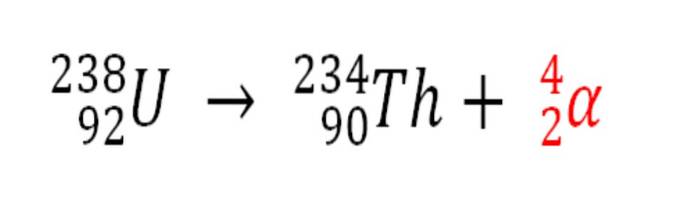
Derfor, i klipperne, hvor disse radioaktive mineraler er koncentreret, vil heliumatomer blive fanget, som frigives, når de er fordøjet i sure medier..
Blandt nogle af disse mineraler er cleveite, carnotite og uraninite, alle sammensat af uranoxider (UOto eller U3ELLER8) og thorium, tungmetal og urenheder i sjældne jordarter. Helium, overrislet gennem underjordiske kanaler, kan ende med at akkumuleres i naturgasreservoirer, mineralskilder eller i meteoriske jern.
Det anslås, at der produceres en heliummængde svarende til 3000 tons årligt i litosfæren fra det radioaktive henfald af uran og thorium..
Luft og hav
Helium er ikke meget opløseligt i vand, så det snarere end senere stiger op fra dybden (uanset hvor dets oprindelse er), indtil det krydser lagene i atmosfæren og endelig når det ydre rum. Dens atomer er så små og lette, at jordens tyngdefelt ikke kan tilbageholde dem i atmosfæren..
På grund af ovenstående er koncentrationen af helium både i luften (5,2 ppm) og i havene (4 ppt) meget lav..
Hvis vi ønskede at udvinde det fra et af disse to medier, ville den "bedste" mulighed være luft, som først skulle udsættes for kondensering for at kondensere alle dens komponentgasser, mens helium forbliver i gasform..
Imidlertid er det ikke praktisk at få helium fra luften, men fra klipper beriget med radioaktive mineraler; eller bedre endnu, fra naturgasreserver, hvor helium kan udgøre op til 7% af dets samlede masse.
Flydning og destillation af naturgas
I stedet for at flydende luften er det lettere og mere rentabelt at bruge naturgas, hvis heliumsammensætning utvivlsomt er meget større. Således er råmaterialet par excellence (kommercielt) til opnåelse af helium naturgas, som også kan udsættes for fraktioneret destillation.
Det endelige produkt af destillationen afsluttes ved rensning med aktivt kul, hvorigennem et meget rent helium passerer igennem. Og endelig adskilles helium fra neon ved en kryogen proces, hvor der anvendes flydende helium..
Isotoper
Helium forekommer overvejende i naturen som isotopen 4Han, hvis nøgne kerne er den berømte α-partikel. Dette atom af 4Han har to neutroner og to protoner. I mindre overflod er isotopen 3Han, der kun har en neutron. Den første er tungere (har en højere atommasse) end den anden.
Således er isotopparret 3Jeg har og 4Han er dem, der definerer de målbare egenskaber, og hvad vi forstår af helium som et kemisk element. Siden den 3Han er lettere, det antages, at dets atomer har højere kinetisk energi, og at de derfor har brug for en endnu lavere temperatur til samhørighed i en superfluid.
Det 3Han betragtes som en meget sjælden art her på Jorden; på månens jord er det dog mere rigeligt (ca. 2000 gange mere). Derfor har månen været genstand for projekter og historier som en mulig kilde til 3Han, som kunne bruges som atombrændstof til fremtidens rumfartøjer.
Blandt andre isotoper af helium kan følgende nævnes med deres respektive halveringstider: 5Jeg har (t1/2= 7,610−22 s), 6Jeg har (t1/2= 0,8 s) og 8Jeg har (t1/2= 0,119 s).
Risici
Helium er en inaktiv gas og deltager derfor ikke i nogen af de reaktioner, der forekommer i vores kroppe..
Dens atomer kommer praktisk talt ind og ud udåndet uden deres interaktion med biomolekyler, der producerer en efterfølgende effekt; bortset fra lyden fra stemmebåndene, som bliver højere og har højere frekvens.
Folk, der indånder helium fra en ballon (i moderation) taler med en høj stemme svarende til en egerns (eller and).
Problemet er, at hvis han inhalerer en uhensigtsmæssig mængde helium, risikerer han kvælning, da dets atomer fortrænger iltmolekylerne; og derfor vil du ikke være i stand til at trække vejret, før du udånder alt det helium, hvilket igen på grund af dets tryk kan rive lungevævet eller forårsage barotrauma.
Tilfælde af mennesker, der er døde af inhalation af helium, er blevet rapporteret på grund af det, der lige er blevet forklaret.
På den anden side, selvom det ikke repræsenterer en brandrisiko i betragtning af sin manglende reaktivitet over for ilt (eller et andet stof), hvis det opbevares under højt tryk og det undslipper, kan dets lækage være fysisk farligt..
Ansøgninger
Heliums fysiske og kemiske egenskaber gør det ikke kun til en speciel gas, men også til et meget nyttigt stof til applikationer, der kræver ekstremt lave temperaturer. I dette afsnit vil nogle af disse applikationer eller anvendelser blive behandlet..
Tryk- og udluftningssystemer
I nogle systemer er det nødvendigt at øge trykket (under tryk), og til dette skal der injiceres eller tilføres en gas, der ikke interagerer med nogen af dens komponenter; f.eks. med reagenser eller overflader, der er følsomme over for uønskede reaktioner.
Således kan trykket øges med volumener af helium, hvis kemiske inaktivitet gør det ideelt til dette formål. Den inerte atmosfære, som det letter, overstiger i visse tilfælde kvælstof.
Til den omvendte proces, dvs. udrensningen, bruges helium også på grund af dets evne til at bære alt ilt, vanddampe eller enhver anden gas, hvis tilstedeværelse du vil fjerne. På denne måde reduceres systemets tryk, når heliumet er tømt..
Lækagedetektioner
Helium kan lække gennem den mindste revne, så det tjener også til at opdage lækager i rør, højvakuumbeholdere eller kryogene tanke.
Nogle gange kan detektering udføres visuelt eller ved berøring; dog er det meste en detektor, der “giver” signalet om, hvor og hvor meget helium der undslipper fra systemet under inspektion..
Transportgas
Heliumatomer kan, som nævnt for udrensningssystemer, bære tungere molekyler afhængigt af deres tryk. For eksempel anvendes dette princip dagligt i gaskromatografianalyse, da det kan trække den forstøvede prøve langs søjlen, hvor den interagerer med den stationære fase..
Balloner og luftskibe

På grund af dens lave tæthed i forhold til luft og igen manglen på reaktivitet med ilt er det blevet brugt til at blæse balloner op til børnefester (blandet med ilt, så ingen kvæles ved at trække vejret) og luftskibe (øverste billede) uden at udgøre en brandrisiko.
Dykning

Når dykkere ned til større dybder, har de svært ved at trække vejret på grund af det store tryk, der udøves af vandet. Derfor tilsættes helium til deres ilttanke for at mindske tætheden af den gas, som dykkere ånder og ånder ud, og det kan således udåndes med mindre arbejde..
Buesvejsninger
I svejseprocessen giver den elektriske lysbue tilstrækkelig varme til, at de to metaller kan komme sammen. Hvis det gøres under en heliumatmosfære, vil det glødende metal ikke reagere med iltet i luften for at blive dets respektive oxid; derfor forhindrer helium dette i at ske.
Superledere
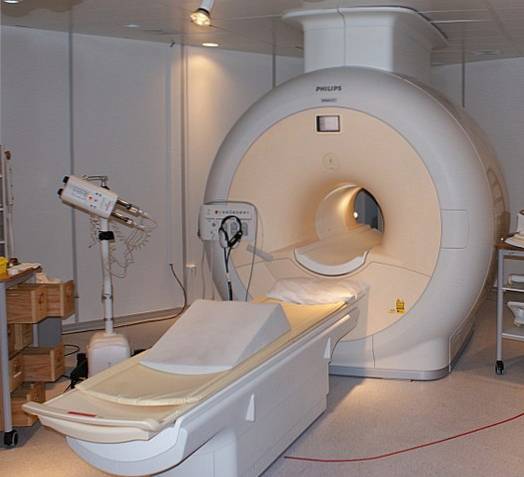
Flydende helium er så koldt, at det kan fryse metaller i superledere. Takket være dette har det været muligt at fremstille meget kraftige magneter, som, afkølet med flydende helium, er blevet brugt i billedscannere eller nukleare magnetiske resonansspektrometre..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Andy Extance. (17. april 2019). Heliumhydridion detekteret i rummet for første gang: bevis fundet for undvigende kemi fra universets første minutter. Gendannet fra: chemistryworld.com
- Peter Wothers. (19. august 2009). Helium. Kemi i sit element. Gendannet fra: chemistryworld.com
- Wikipedia. (2019). Helium. Gendannet fra: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M., & Bassett, W. A. (1988). Krystalstruktur og tæthed af Helium op til 232 Kbar. Gendannet fra: articles.adsabs.harvard.edu
- National Center for Biotechnology Information. (2019). Helium. PubChem-database. CID = 23987. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (6. februar 2017). Op, op og væk: Kemikere siger 'ja', helium kan danne forbindelser. Utah State University. Gendannet fra: phys.org
- Steve Gagnon. (s.f.). Isotoper af Element Helium. Jefferson Lab. Gendannet fra: education.jlab.org
- Advameg, Inc. (2019). Helium. Gendannet fra: chemistryexplained.com
Endnu ingen kommentarer