
Hexokinase strukturer, funktioner, former

Det hexokinase (HK) er det enzym, der katalyserer den første reaktion af den glykolytiske vej i næsten alle levende organismer, både prokaryoter og eukaryoter. Det er ansvarligt for overførslen af en phosphorylgruppe til glucose, der producerer glucose-6P, skønt den også kan phosphorylere andre sukkerhexoser (6 carbonatomer).
Dette enzym er klassificeret inden for en af de to familier af glucosekinaseenzymer (enzymer, der overfører phosphorylgrupper til substrater såsom glucose): hexokinase (HK) -familien, hvis medlemmer er opdelt i tre forskellige grupper kendt som HK-gruppen, gruppen A og gruppe B.
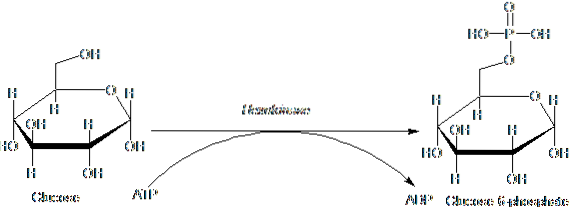
Enzymerne, der hører til HK-familien, er kendetegnet ved phosphorylerende glucose på bekostning af ATP som et phosphorylgruppedonormolekyle, og dets medlemmer adskiller sig primært med hensyn til deres molekylvægt og substratspecificitet..
HK-gruppen inkluderer enzymerne fra eukaryote organismer (ATP: D-hexose 6-phosphotransferaser), mens gruppe A er repræsenteret af enzymerne fra gramnegative bakterier, cyanobakterier, amitokondriatprotister og trypanosomatider, og gruppe B indeholder enzymerne grampositive bakterier og crenoqueotiske organismer.
Gruppe A og B enzymer er også kendt som glucokinaser (GlcKs), da de udelukkende er i stand til at phosphorylere glucose, hvorfor disse enzymer kaldes ATP: D-glucose 6-phosphotransferaser.
Som et glykolytisk enzym har hexokinase stor metabolisk betydning, da uden denne vigtige vej ikke ville være mulig, og celler, der var stærkt afhængige af kulhydratforbrug, såsom hjernen og muskelcellerne hos mange pattedyr, ville have alvorlige funktionelle og fysiologiske hindringer generelt.
Artikelindeks
- 1 Struktur
- 2 funktioner
- 2.1 I planter
- 3 figurer
- 4 Referencer
Struktur
Som det vil fremgå senere, findes der forskellige typer hexokinase-enzymer i pattedyr og andre hvirveldyr (såvel som i encellede organismer såsom gær). Hos pattedyr er fire blevet beskrevet: isoformer I, II, III og IV.
De første tre isozymer har en molekylvægt på 100 kDa, men isozym IV har 50 kDa. Disse isoenzymer (især I-III) udviser høj sekvenslighed mellem dem med hensyn til deres C- og N-terminaler såvel som med andre medlemmer af hexokinase-familien..
Disse enzymers N-terminale domæne betragtes som det "regulatoriske" domæne, medens den katalytiske aktivitet udføres af det C-terminale domæne (pattedyr HK II har aktive steder i begge domæner).
Det N-terminale domæne er bundet til det C-terminale domæne gennem en alfa-helix, hver er ca. 50 kDa i molekylvægt og har et bindingssted for glucose.
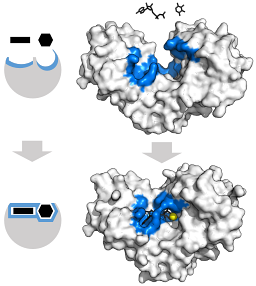
Disse enzymers tertiære struktur er i det væsentlige sammensat af p-foldede ark blandet med alfa-helices, hvis andel varierer med hensyn til enzymet og den pågældende art; bindingsstedet for ATP, det andet substrat for hexokinase, består normalt af fem β-ark og to alfa-helixer.
Funktioner
Hexokinase har en transcendental funktion i kulhydratmetabolismen hos de fleste levende væsener, da det katalyserer det første trin i den glykolytiske vej, der medierer phosphorylering af glukose inde i cellen..
Dette første trin i glykolyse, som består af overførslen af en phosphorylgruppe fra ATP (donor) til glucose, hvilket giver glucose 6-phosphat og ADP, er det første af de to energinvesteringstrin i form af ATP.
Desuden er reaktionen katalyseret af hexokinase trinnet med "aktivering" af glucose til dens efterfølgende behandling og repræsenterer et trin med "engagement", da den således phosphorylerede glucose ikke kan forlade cellen ved hjælp af dens konventionelle transportører i membranen..
Reaktionsproduktet katalyseret af hexokinase, dvs. glucose 6-phosphat, er et forgreningspunkt, da det er det første substrat, der anvendes i pentose-phosphatvejen og i syntesen af glykogen hos mange dyr (og stivelsen i planter).
I planterne
Hexokinase's funktion i planter er ikke særlig forskellig fra dyr eller mikroorganismer, men i højere planter fungerer dette enzym også som en "sensor" for koncentrationen af sukker..
Betydningen af denne funktion i disse organismer har at gøre med sukkers deltagelse som regulatoriske faktorer i ekspressionen af gener, der er involveret i forskellige metaboliske processer såsom:
- Fotosyntese
- Glyoxylatcyklussen
- Vejrtrækningen
- Nedbrydning eller syntese af stivelse og saccharose
- Nitrogenmetabolisme
- Forsvar mod patogener
- Regulering af cellecyklussen
- Den helbredende reaktion
- Pigmentering
- Senescence, blandt andre.
Denne funktion af hexokinase som en "sensor" af mængden af intracellulær glucose er også blevet beskrevet for gær og pattedyr..
Former
I naturen er der forskellige former for hexokinaser, og dette afhænger grundlæggende af den art, der betragtes.
Hos mennesker og andre hvirveldyrsdyr er for eksempel påvist eksistensen af 4 forskellige isoformer af hexokinaseenzymet i det cytosoliske rum, som er betegnet med de romerske tal I, II, III og IV.
Isoenzymer I, II og III har en molekylvægt på 100 kDa, inhiberes af deres reaktionsprodukt (glucose 6-phosphat) og er meget glucose-relaterede, dvs. de har en meget lav Km konstant. Disse enzymer har imidlertid ringe substratspecificitet, idet de er i stand til at phosphorylere andre hexoser såsom fruktose og mannose.
Isoenzyme IV, også kendt som glucokinase (GlcK), har kun 50 kDa i molekylvægt, og på trods af at det er dårligt beslægtet (høje Km-værdier), har det en høj specificitet for glucose som substrat og er ikke udsat for dem. de andre tre isoenzymer.
Glucokinase (isoenzym IV i hexokinase fra mange pattedyr) findes hovedsageligt i leveren og hjælper dette organ med at "justere" dets glukoseforbrug som reaktion på variationer af dette substrat i det cirkulerende blod..
De tre gener, der koder for hexokinaser I, II og III hos dyr, ser ud til at have den samme 50 kDa forfader, der blev duplikeret og fusioneret i genomet, hvilket synes tydeligt, når det observeres, at den katalytiske aktivitet af form I og III kun ligger i den C-terminale ende.
Referencer
- Aronoff, S. L., Berkowitz, K., Shreiner, B., & Want, L. (2004). Glukosemetabolisme og regulering: ud over insulin og glukagon. Diabetes spektrum, 17(3), 183-190.
- Harrington, G. N., og Bush, D. R. (2003). Den bifunktionelle rolle af hexokinase i metabolisme og glukosesignalering. Plantecellen, femten(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L., og Sheen, J. (1997). Hexokinase som sukkersensor i højere planter. Plantecellen, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hypotese: strukturer, evolution og forfader til glukosekinaser i hexokinasefamilien. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, K. E. (1998). Van Holde. Biokemi.
- Wilson, J. E. (2003). Isozymer af pattedyr hexokinase: struktur, subcellulær lokalisering og metabolisk funktion. Journal of Experimental Biology, 206(12), 2049-2057.



Endnu ingen kommentarer