
Wolframhistorie, egenskaber, struktur, anvendelser
Det wolfram, wolfram eller wolfram er et tungt overgangsmetal, hvis kemiske symbol er W. Det er placeret i periode 6 med gruppe 6 i det periodiske system, og dets atomnummer er 74. Navnet har to etymologiske betydninger: hård sten og ulveskum; af det andet er fordi dette metal også er kendt som wolfram.
Det er et sølvgråt metal, og selvom det er skørt, har det stor hårdhed, tæthed og høje smelte- og kogepunkter. Derfor er det blevet brugt i alle de applikationer, der involverer høje temperaturer, tryk eller mekaniske kræfter, såsom bor, projektiler eller strålingsemitterende filamenter..

Den mest kendte anvendelse af dette metal på kulturelt og populært niveau er i glødetrådene til elektriske pærer. Den, der har manipuleret dem, vil indse, hvor skrøbelige de er; dog er de ikke lavet af ren wolfram, som er formbar og duktil. Derudover giver det i metalliske matricer som legeringer fremragende modstandsdygtighed og hårdhed.
Det er karakteriseret og kendetegnet ved at være metallet med det højeste smeltepunkt, og også ved at være tættere end bly i sig selv, kun overgået af andre metaller som osmium og iridium. Det er også det tungeste metal, der er kendt for at spille en biologisk rolle i kroppen..
Wolframatanionen, WO4to-, som kan polymerisere til dannelse af klynger i et surt medium. På den anden side kan wolfram danne intermetalliske forbindelser eller sintres med metaller eller uorganiske salte, så dets faste stoffer får forskellige former eller konsistenser..
Det er ikke særlig rigeligt i jordskorpen med kun 1,5 gram af dette metal pr. Ton. Desuden er dets oprindelse intergalaktisk, da det er et tungt element; specifikt fra supernovaeksplosioner, som skal have kastet “jetfly” af wolframatomer mod vores planet under dens dannelse.
Artikelindeks
- 1 Historie
- 1.1 Etymologi
- 1.2 Anerkendelse og opdagelse
- 1.3 Stål og pærer
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Atomnummer
- 2.3 Molær masse
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Tæthed
- 2.7 Fusionsvarme
- 2.8 Fordampningsvarme
- 2.9 Molær varmekapacitet
- 2.10 Mohs hårdhed
- 2.11 Elektronegativitet
- 2.12 Atomeradius
- 2.13 Elektrisk modstand
- 2.14 Isotoper
- 2.15 Kemi
- 2.16 Syreklynge
- 3 Struktur og elektronisk konfiguration
- 3.1 Krystallinske faser
- 3.2 Metallisk binding
- 3.3 oxidationstilstande
- 4 Opnåelse
- 5 anvendelser
- 6 Risici og forholdsregler
- 6.1 Biologiske stoffer
- 6.2 Fysisk
- 7 Referencer
Historie
Etymologi
Historien om wolfram eller wolfram har to ansigter som deres navne: en schweizisk og den anden tysk. I 1600'erne, i regioner, der i øjeblikket er besat af Tyskland og Østrig, arbejdede minearbejdere i ekstraktioner af kobber og tin for at producere bronze.
Dengang fandt minearbejdere sig med en torn i processen: der var et ekstremt vanskeligt mineral at smelte; mineral bestående af wolframit, (Fe, Mn, Mg) WO4, som tilbageholdt eller "fortærede" tin som om det var en ulv.
Derfor etymologi for dette element, 'ulv' for ulv på spansk, en ulv, der spiste tin; og 'ram' af skum eller fløde, hvis krystaller lignede en lang sort pels. Det var således, at navnet 'wolfram' eller 'wolfram' opstod til ære for disse første observationer.
I 1758, på den schweiziske side, et lignende mineral, scheelite, CaWO4, det blev kaldt 'tung sten', hvilket betyder 'hård sten'.
Begge navne, wolfram og wolfram, er meget udskifteligt, afhængigt udelukkende af kultur. I Spanien for eksempel og i Vesteuropa er dette metal bedst kendt som wolfram; mens på det amerikanske kontinent dominerer navnet wolfram.
Anerkendelse og opdagelse
Det vides da, at der mellem det syttende og attende århundrede var to mineraler: wolframit og scheelite. Men hvem så, at der var et andet metal end de andre i dem? De kunne kun karakteriseres som mineraler, og det var i 1779, at den irske kemiker Peter Woulfe omhyggeligt analyserede wolfram og udledte eksistensen af wolfram..
På den schweiziske side var Carl Wilhelm Scheele i 1781 i stand til at isolere wolfram som WO3; og endnu mere opnåede han wolframsyre (eller wolframsyre), HtoWO4 og andre forbindelser.
Dette var imidlertid ikke nok til at komme til det rene metal, da det var nødvendigt at reducere denne syre; det vil sige at udsætte den for en sådan proces, at den er bundet til ilt og krystalliseres som metal. Carl Wilhelm Scheele havde ikke de passende ovne eller metoden til denne kemiske reduktionsreaktion.
Det er her, hvor de spanske brødre d'Elhuyar, Fausto og Juan José, kom til handling, som reducerede begge mineraler (wolframit og scheelite) med kul i byen Bergara. Begge tildeles fortjeneste og ære for at være opdagere af metallisk wolfram eller wolfram (W).
Stål og pærer

Ligesom andre metaller definerer dets anvendelser dets historie. Blandt de mest fremtrædende i slutningen af det 19. århundrede var stål-wolframlegeringer og wolframfilamenter til erstatning af kulstof i elektriske pærer. Det kan siges, at de første pærer, som vi kender dem, blev markedsført i 1903-1904.
Ejendomme
Fysisk fremtoning
Det er et skinnende sølvgråt metal. Skør, men meget hård (ikke at forveksle med sejhed). Hvis stykket er af høj renhed, bliver det formbart og hårdt, så meget eller mere som flere stål.
Atom nummer
74.
Molar masse
183,85 g / mol.
Smeltepunkt
3422ºC.
Kogepunkt
5930ºC.
Massefylde
19,3 g / ml.
Fusionsvarme
52,31 kJ / mol.
Fordampningsvarme
774 kJ / mol.
Molær varmekapacitet
24,27 kJ / mol.
Mohs hårdhed
7.5.
Elektronegativitet
2,36 på Pauling-skalaen.
Atomic radio
Kl
Elektrisk modstand
52,8 nΩ · m ved 20 ° C.
Isotoper
Det forekommer overvejende i naturen som fem isotoper: 182W, 183W, 184W, 186Tryllestav 180W. Ifølge den molære masse på 183 g / mol, som gennemsnit af atommasserne af disse isotoper (og de andre tredive radioisotoper), har hvert wolfram- eller wolframatom omkring hundrede og ti neutroner (74 + 110 = 184).
Kemi
Det er et metal, der er meget modstandsdygtigt over for korrosion, da dets tynde lag af WO3 Det beskytter det mod angreb af ilt, syre og baser. Når de er opløst og udfældet med andre reagenser, opnås dens salte, der kaldes wolframater eller wolframater; i dem har wolfram normalt en oxidationstilstand på +6 (forudsat at der er kationer W6+).
Syreklynge
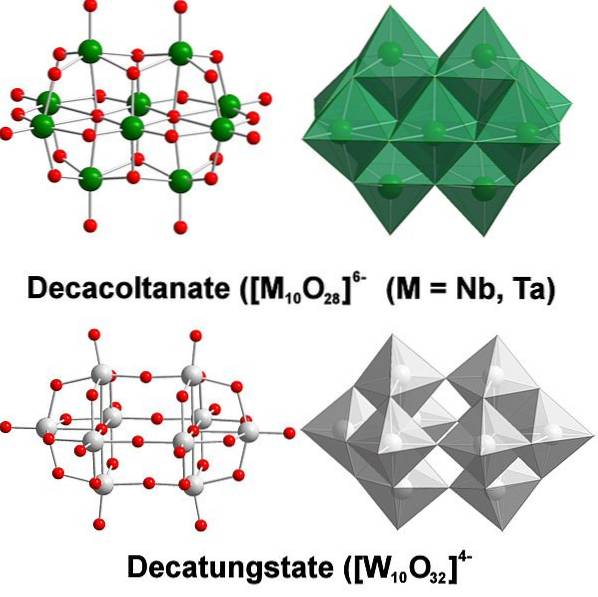
Kemisk er wolfram ganske særlig, fordi dets ioner har tendens til at gruppere sig for at danne heteropolysyrer eller polyoxometalater. Hvad er de? De er grupper eller klynger af atomer, der kommer sammen for at definere en tredimensionel krop; Hovedsageligt en med en sfærisk burlignende struktur, hvor de "omslutter" et andet atom.
Det hele starter fra wolframstatianionen, WO4to-, som i surt medium hurtigt protoneres (HWO4-) og binder med en nærliggende anion for at danne [WtoELLER7(OH)to]to-; og dette tilslutter sig igen med en anden [WtoELLER7(OH)to]to- at stamme fra [W4ELLER12(OH)4]4-. Så videre, indtil der er flere politiske statistikker i løsning.
Paratungstat A og B, [W7ELLER24]6- og HtoW12ELLER4210-, henholdsvis de er en af de mest fremragende af disse polyanioner.
Det kan være udfordrende at komme med dine Lewis-konturer og strukturer; men det er i princippet nok at visualisere dem som sæt af WO octahedra6 (øverste billede).
Bemærk, at disse grålig oktaeder slutter med at definere decatungstate, en politungstat; hvis det indeholdt et heteroatom (for eksempel fosfor) indeni, ville det være et polyoxometalat.
Struktur og elektronisk konfiguration
Krystallinske faser
Wolframatomer definerer en krystal med en kropscentreret kubisk struktur (bcc, for kropscentreret kubik). Denne krystallinske form er kendt som a-fasen; mens β-fasen også er kubisk, men lidt mere tæt. Begge faser eller krystallinske former, α og β, kan eksistere sammen i ligevægt under normale forhold.
De krystallinske korn i α-fasen er isometriske, mens de i β-fasen ligner søjler. Uanset hvordan krystallen er, styres den af de metalliske bindinger, der holder W-atomerne tæt sammen. Ellers kunne de høje smelte- og kogepunkter eller wolframens høje hårdhed og densitet ikke forklares..
Metallisk binding
Wolframatomer skal være tæt bundet på en eller anden måde. For at antage, skal elektronkonfigurationen af dette metal først overholdes:
[Xe] 4f145 d46sto
De 5d orbitaler er meget store og uklare, hvilket ville antyde, at der mellem to nærliggende W-atomer er effektive orbitale overlapninger. Ligeledes bidrager 6s orbitaler til de resulterende bånd, men i mindre grad. Mens 4f-orbitalerne er "dybt i baggrunden", og derfor er deres bidrag til den metalliske binding mindre.
Dette, størrelsen af atomerne og de krystallinske korn, er de variabler, der bestemmer hårdheden af wolfram og dens densitet..
Oxidationstilstande
I wolfram eller metallisk wolfram har W-atomer nul oxidationstilstand (W0). Når vi vender tilbage til den elektroniske konfiguration, kan 5d- og 6s-orbitalerne "tømmes" for elektroner afhængigt af om W er i selskab med stærkt elektronegative atomer, såsom ilt eller fluor..
Når de to 6s elektroner går tabt, har wolfram oxidationstilstand +2 (Wto+), som får sit atom til at trække sig sammen.
Hvis det også mister alle elektroner i sine 5d orbitaler, bliver dets oxidationstilstand +6 (W6+); Herfra kan det ikke blive mere positivt (i teorien), da 4f-orbitaler, fordi de er interne, ville kræve store energier for at fjerne deres elektroner. Det vil sige, den mest positive oxidationstilstand er +6, hvor wolfram er endnu mindre.
Denne wolfram (VI) er meget stabil under sure forhold eller i mange iltede eller halogenerede forbindelser. Andre mulige og positive oxidationstilstande er: +1, +2, +3, +4, +5 og +6.
Wolfram kan også få elektroner, hvis det kombineres med atomer, der er mindre elektronegative end det. I dette tilfælde bliver dets atomer større. Det kan maksimalt få fire elektroner; dvs. have en oxidationstilstand på -4 (W.4-).
Opnåelse
Det blev nævnt tidligere, at wolfram findes i mineralerne wolframit og scheelite. Afhængig af fremgangsmåden opnås to forbindelser fra dem: wolframoxid, WO3, eller ammoniumparatungstat, (NH4)10(HtoW12ELLER42) · 4HtoO (eller ATP). En af dem kan reduceres til metallisk W med kulstof over 1050 ° C.
Det er ikke økonomisk rentabelt at producere wolframstænger, da de har brug for meget varme (og penge) for at smelte dem. Derfor foretrækkes det at fremstille det i pulverform til at behandle det med en gang med andre metaller for at opnå legeringer..
Det er værd at nævne, at Kina er det land med den største wolframproduktion på verdensplan. Og på det amerikanske kontinent, Canada, Bolivia og Brasilien, besætter de også listen over de største producenter af dette metal.
Ansøgninger

Her er nogle af de kendte anvendelser til dette metal:
-Dens salte blev brugt til at farve bomuld af gammel teaterdragt.
-Kombineret med stål hærder det det endnu mere og er i stand til selv at modstå mekaniske nedskæringer ved høje hastigheder.
-Sintrede wolframfilamenter er blevet brugt i over hundrede år i elektriske pærer og halogenlamper. På grund af dets høje smeltepunkt har det også fungeret som et materiale til katodestrålerør og til dyserne på raketmotorer..
-Erstatter bly i fremstillingen af projektiler og radioaktive skjolde.
-Wolfram nanotråde kan bruges i pH og gasfølsomme nanordrivere.
-Wolframkatalysatorer blev brugt til at håndtere svovlproduktion i olieindustrien.
-Wolframcarbid er den mest anvendte af alle dets forbindelser. Fra styrkelse af skære- og boreværktøj eller fremstilling af stykker af militærrustning til bearbejdning af træ, plast og keramik.
Risici og forholdsregler
Biologisk
At være et relativt sjældent metal i jordskorpen, og dets negative virkninger er knappe. I sure jordarter påvirker polyungstater muligvis ikke de enzymer, der bruger molybdatanioner; men i grundjord, WO4to- griber ind (positivt eller negativt) i de metaboliske processer i MoO4to- og kobber.
Planter kan for eksempel absorbere opløselige wolframforbindelser, og når et dyr spiser dem og derefter efter indtagelse af kødet, kommer W-atomer ind i vores kroppe. De fleste udvises i urin og afføring, og man ved ikke meget, hvad der sker med resten af dem..
Dyrestudier har vist, at når de inhalerer høje koncentrationer af pulveriseret wolfram, udvikler de symptomer, der ligner lungekræft.
Ved indtagelse ville et voksent menneske have brug for at drikke tusindvis af liter vand beriget med wolframsalte for at udvise mærkbar inhibering af enzymerne cholinesterase og phosphatase..
Fysisk
Generelt er wolfram et lavt toksisk element, og derfor er der få miljømæssige risici for sundhedsskader..
Med hensyn til metallisk wolfram, undgå at indånde dets støv; og hvis prøven er fast, skal man huske på, at den er meget tæt, og at den kan forårsage fysisk skade, hvis den falder ned eller rammer andre overflader.
Referencer
- Bell Terence. (s.f.). Wolfram (Wolfram): Egenskaber, produktion, applikationer og legeringer. Balancen. Gendannet fra: thebalance.com
- Wikipedia. (2019). Wolfram. Gendannet fra: en.wikipedia.org
- Lenntech B.V. (2019). Wolfram. Gendannet fra: lenntech.com
- Jeff Desjardins. (1. maj 2017). Historien om wolfram, det stærkeste naturlige metal på jorden. Gendannet fra: visualcapitalist.com
- Doug Stewart. (2019). Wolfram Element Fakta. Gendannet fra: chemicool.com
- Art Fisher og Pam Powell. (s.f.). Wolfram. University of Nevada. Gendannet fra: unce.unr.edu
- Helmenstine, Anne Marie, Ph.D. (2. marts 2019). Wolfram- eller Wolfram-fakta. Gendannet fra: thoughtco.com



Endnu ingen kommentarer