
Alifatiske kulbrinteregenskaber, nomenklatur, reaktioner, typer
Det Alifatiske kulbrinter er alle dem, der mangler aromatiske egenskaber, ikke i en olfaktorisk forstand, men med hensyn til kemisk stabilitet. Klassificering af kulbrinter på denne måde er i dag for tvetydig og upræcis, da det ikke skelner mellem forskellige typer carbonhydrider, der ikke er aromatiske..
Således har vi alifatiske carbonhydrider og aromatiske carbonhydrider. Sidstnævnte genkendes af deres basisenhed: benzenringen. De andre kan på den anden side vedtage en hvilken som helst molekylær struktur: lineær, forgrenet, cyklisk, umættet, polycyklisk; så længe de ikke har konjugerede systemer som benzen.

Udtrykket 'alifatisk' blev født af det græske ord 'aleiphar', som betyder fedt, også brugt til at henvise til olier. Derfor blev denne klassificering i det 19. århundrede tildelt carbonhydrider opnået fra olieagtige ekstrakter; mens aromatiske carbonhydrider blev ekstraheret fra træharpikser og duftende.
Da fundamentet for organisk kemi blev konsolideret, blev det imidlertid opdaget, at der var en kemisk egenskab, der differentierede kulbrinter, endnu vigtigere end deres naturlige kilder: aromatisitet (og ikke duft).
På denne måde ophørte alifatiske kulbrinter kun at være dem, der er fremstillet af fedt, for at være alle dem, der mangler aromatiske egenskaber. Inden for denne familie har vi alkaner, alkener og alkyner, uanset om de er lineære eller cykliske. Derfor betragtes 'alifatisk' som upræcis; skønt det er nyttigt at tage fat på nogle generelle aspekter.
For eksempel, når du siger alifatiske 'ender' eller 'kæder', henviser du til molekylære regioner, hvor aromatiske ringe er fraværende. Af alle de alifatiske kulbrinter er den enkleste pr. Definition methan, CH4; mens benzen er den enkleste af de aromatiske carbonhydrider.
Artikelindeks
- 1 Egenskaber for alifatiske kulbrinter
- 2 Nomenklatur
- 3 Reaktioner
- 3.1 Forbrænding
- 3.2 Tilføjelse
- 3.3 Halogenering
- 3.4 Revner
- 4 typer
- 5 anvendelser
- 6 eksempler
- 7 Referencer
Egenskaber for alifatiske kulbrinter
Egenskaberne af alifatiske kulbrinter varierer i forskellige grader afhængigt af hvilke der betragtes. Der er masser af lave og høje molekyler såvel som lineære, forgrenede, cykliske eller polycykliske, selv dem med forbløffende tredimensionelle strukturer; som med den cubanske, terningformede.
Der er dog nogle generaliteter, der kan nævnes. De fleste alifatiske kulbrinter er hydrofobe og apolære gasser eller væsker med nogle mere apolære end andre, da selv dem, i hvis carbonkæder indeholder halogen-, ilt-, nitrogen- eller svovlatomer er inkluderet..
Ligeledes er de brandfarlige forbindelser, da de er modtagelige for oxidation i luften med en minimal varmekilde. Denne egenskab bliver farligere, hvis vi tilføjer dens høje flygtighed på grund af de svage dispersive interaktioner, der holder alifatiske molekyler sammen..
Vi ser dette for eksempel i butan, en gas, der relativt let kan flydende ligesom propan. Begge er meget flygtige og brandfarlige, hvilket gør dem til aktive komponenter i kogegas eller lightere..
Naturligvis har denne flygtighed tendens til at falde, når molekylvægten stiger, og carbonhydridet producerer stadig mere viskøse og olieagtige væsker..
Nomenklatur
Nomenklaturen for kulbrinter adskiller sig endnu mere end deres egenskaber. Hvis de er alkaner, alkener eller alkyner, følges de samme regler, der er fastsat af IUPAC: vælg den længste kæde, tildel de laveste indikatornumre til den mest substituerede ende eller til de mest reaktive heteroatomer eller grupper.
På denne måde vides det, på hvilket kulstof hver substituent findes, eller endda umættningerne (dobbelt- eller tredobbeltbindinger). I tilfælde af cykliske carbonhydrider er navnet forud for de substituenter, der er anført i alfabetisk rækkefølge, efterfulgt af ordet 'cyklus', der tæller de carbonantal, der omfatter det..
Overvej f.eks. Følgende to cyclohexaner:
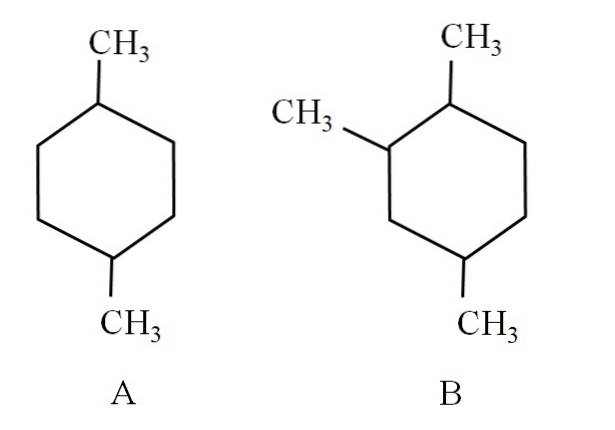
Cyclohexan A kaldes 1,4-dimethylcyclohexan. Hvis ringen var fem carbonatomer, ville den være 1,4-dimethylcyclopentan. I mellemtiden kaldes cyclohexan B 1,2,4-trimethylcyclohexan og ikke 1,4,6-cyclohexan, da det søger at bruge de laveste indikatorer.
Nu kan nomenklaturen blive meget kompliceret for kulbrinter med bizarre strukturer. For dem er der mere specifikke regler, som skal forklares særskilt og omhyggeligt; som med diener, terpener, polyener og polycykliske forbindelser.
Reaktioner
Forbrænding
Heldigvis er reaktionerne mindre varierede for disse kulbrinter. En af dem er allerede blevet nævnt: de brænder let og producerer kuldioxid og vand samt andre oxider eller gasser afhængigt af tilstedeværelsen af heteroatomer (Cl, N, P, O osv.). COto og HtoEller er de de vigtigste forbrændingsprodukter.
Tilføjelse
Hvis de præsenterer umættethed, kan de gennemgå additionsreaktioner; det vil sige, de inkorporerer små molekyler i deres rygrader som substituenter efter en specifik mekanisme. Blandt disse molekyler har vi vand, brint og halogener (Fto, Clto, Brto og jegto).
Halogenering
På den anden side er alifatiske kulbrinter under forekomsten af ultraviolet stråling (hv) og varme kan bryde C-H-obligationer for at udveksle dem med C-X-obligationer (CF, C-Cl osv.). Dette er halogeneringsreaktionen, som observeres i meget kortkædede alkaner, såsom methan eller pentan..
Revner
En anden reaktion, som alifatiske kulbrinter, især langkædede alkaner, kan gennemgå, er termisk krakning. Den består af tilførsel af intens varme, så den termiske energi bryder C-C-bindingerne, og derved dannes små molekyler, mere værdsat på brændstofmarkedet, fra store molekyler.
De fire ovenfor nævnte reaktioner er de vigtigste, som et alifatisk carbonhydrid kan gennemgå, idet forbrænding er det vigtigste af alt, da det ikke diskriminerer nogen forbindelse; alle brænder i nærvær af ilt, men ikke alle tilføjer molekyler eller nedbrydes i små molekyler.
Typer
Alifatiske kulbrinter grupperer et uendeligt antal forbindelser, som igen klassificeres på en mere specifik måde, hvilket indikerer graden af deres umættethed samt den type struktur, de har..
I henhold til hvor umættede de er, har vi alkaner (mættede), alkener og alkyner (umættede).
Alkaner er kendetegnet ved at have enkelt-C-bindinger, mens vi i alkener og alkyner observerer henholdsvis C = C og C-C-bindinger. En meget generel måde at visualisere dem på er at tænke på karbonskeletter af alkaner som zigzaggende og bøjede kæder, der er "firkanter" for alkener og "lige linjer" for alkyner.
Dette skyldes det faktum, at de dobbelte og tredobbelte bindinger præsenterer energi og sterisk begrænsning i deres rotationer, "hærder" deres strukturer..
Alkaner, alkener og alkyner kan være forgrenede, cykliske eller polycykliske. Derfor betragtes cycloalkaner, cycloalkener, cycloalkiner og forbindelser såsom decalin (bicyclostruktur), adamantan (ligner en baseballkappe), heptalen, gonan, blandt andre også alifatiske kulbrinter..
Andre typer carbonhydrider stammer fra alkener, såsom diener (med to dobbeltbindinger), polyener (med mange alternerende dobbeltbindinger) og terpener (forbindelser afledt af isopren, en dien).
Ansøgninger
Igen kan anvendelserne af disse kulbrinter variere afhængigt af hvilken der betragtes. I egenskabs- og reaktionssektionerne blev det imidlertid gjort klart, at de alle brændte, ikke kun for at frigive luftformige molekyler, men også lys og varme. De er således energireservoirer, der er nyttige til at tjene som brændstof eller varmekilder..
Derfor bruges de som en del af sammensætningen af benzin til naturgas i Bunsen-brændere og generelt til at kunne starte brande..
Et af de mest bemærkelsesværdige eksempler er acetylen, HC2CH, hvis forbrænding gør det muligt for metalionerne i en prøve at blive exciteret i atomabsorptionsspektrometri udført i analytiske tests. Den resulterende brand kan også bruges til svejsning.
Flydende alifatiske kulbrinter, såsom paraffiniske stoffer, anvendes ofte som ekstraktionsopløsningsmidler til fedt. Derudover kan dets opløsningsmiddelvirkning bruges til at fjerne pletter, emaljer, maling eller simpelthen til at fremstille opløsninger af en bestemt organisk forbindelse.
Dem med den højeste molekylvægt, hvad enten det er tyktflydende eller fast, anvendes til produktion af harpikser, polymerer eller medicin.
Hvad angår udtrykket 'alifatisk' bruges det ofte til at henvise til de regioner, i et makromolekyle, der mangler aromatiske egenskaber. For eksempel beskrives asfaltener overfladisk som en aromatisk kerne med alifatiske kæder.
Eksempler
Først blev det sagt, at metan er den enkleste af de alifatiske kulbrinter. Det efterfølges af propan, CH3CHtoCH3, butan, CH3CHtoCHtoCH3, pentan, CH3CHtoCHtoCHtoCH3, octan, nonan, dekan og så videre med længere og længere alkaner.
Det samme gælder for ethylen, CHto= CHto, propen, CH3CH = CHto, buten, CH3CHtoCH = CH3, og for resten af alkynerne. Hvis der er to dobbeltbindinger, er de diener, og hvis der er mere end to, polyener. Ligeledes kan der være dobbelt- og tredobbeltbindinger i samme skelet, hvilket øger strukturel kompleksitet..
Blandt cycloalkanerne kan vi nævne cyclopropan, cyclobutan, cyclopentan, cyclohexan, cycloheptan, cyclooctan såvel som cyclohexen og cyclohexin. Forgrenede derivater opnås igen fra alle disse carbonhydrider, de tilgængelige eksempler multipliceres endnu mere (såsom 1,4-dimethylcyclohexan).
Af de mest repræsentative terpener har vi limonen, menthol, pinen, vitamin A, squalen osv. Polyethylen er en polymer mættet med -CH enhederto-CHto-, så det er også et eksempel på disse kulbrinter. Andre eksempler er allerede nævnt i de foregående afsnit.
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Helmenstine, Anne Marie, Ph.D. (22. august 2019). Definition af alifatisk kulbrinte. Gendannet fra: thoughtco.com
- Wikipedia. (2019). Alifatisk forbindelse. Gendannet fra: en.wikipedia.org
- Kemi LibreTexts. (20. august 2019). Alifatiske kulbrinter. Gendannet fra: chem.libretexts.org
- Elizabeth Wyman. (2019). Alifatiske kulbrinter: Definition og egenskaber. Undersøgelse. Gendannet fra: study.com


Endnu ingen kommentarer