
Umættede kulbrinteregenskaber og eksempler

Det umættede kulbrinter er dem, der indeholder mindst en carbon-dobbeltbinding i deres struktur, der er i stand til at indeholde en tredobbeltbinding, da mætning af en kæde betyder, at den har modtaget alle mulige hydrogenatomer i hvert carbon, og der er ingen par frie elektroner, hvor flere hydrogener kan komme ind.
Umættede kulbrinter er opdelt i to typer: alkener og alkyner. Alkener er carbonhydridforbindelser, der har en eller flere dobbeltbindinger i deres molekyle. I mellemtiden er alkyner carbonhydridforbindelser, der har en eller flere tredobbelte bindinger inden for deres formel..
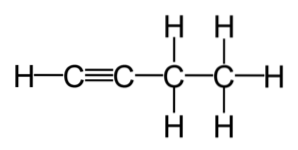
Alkener og alkyner anvendes ofte kommercielt. Disse er forbindelser med et højere reaktivitetsniveau end mættede kulbrinter, hvilket gør dem til udgangspunktet for mange reaktioner, genereret fra de mest almindelige alkener og alkyner..
Artikelindeks
- 1 Nomenklatur
- 1.1 Nomenklatur for alkener
- 1.2 Nomenklatur for alkyner
- 2 egenskaber
- 2.1 Dobbelt og tredobbelt binding
- 2.2 cis-trans isomerisering
- 2.3 Surhed
- 2.4 Polaritet
- 2.5 Kogepunkter og smeltepunkter
- 3 eksempler
- 3.1 Ethylen (C2H4)
- 3.2 Ethin (C2H2)
- 3.3 Propylen (C3H6)
- 3.4 Cyclopenten (C5H8)
- 4 Artikler af interesse
- 5 Referencer
Nomenklatur
Umættede kulbrinter navngives forskelligt afhængigt af om de er alkener eller alkyner ved hjælp af suffikserne "-eno" og "-ino".
Alkener har mindst en carbon-carbon dobbeltbinding i deres struktur og har den generelle formel CnH2n, mens alkyner indeholder mindst en tredobbelt binding og håndteres med formlen CnH2n-2.
Nomenklatur for alkener
For at navngive alkener skal positionerne for carbon-carbon dobbeltbindingerne angives. Navnene på kemiske forbindelser, der indeholder C = C-bindinger, slutter med suffikset "-eno".
Som med alkaner bestemmes navnet på baseforbindelsen af antallet af carbonatomer i den længste kæde. For eksempel er molekylet CHto= CH-CHto-CH3 vil blive kaldt "1-buten", men H3C-CH = CH-CH3 vil kalde sig selv "2-buten".
De tal, der observeres i navnene på disse forbindelser, angiver carbonatomet med det mindste tal i kæden, hvor alkenens C = C-binding er placeret..
Antallet af carbonatomer i denne kæde identificerer prefikset for navnet, svarende til alkaner ("met-", "et-", "pro-", "but-" osv.), Men bruger altid suffikset "-eno ".
Det skal også specificeres, om molekylet er cis eller trans, som er typer geometriske isomerer. Dette tilsættes i navnet, såsom 3-ethyl-cis-2-heptan eller 3-ethyl-trans-2-heptan.
Nomenklatur for alkyner
For at gætte navnene på kemiske forbindelser, der indeholder tredobbelte C≡C-bindinger, bestemmes navnet på forbindelsen af antallet af C-atomer i den længste kæde.
Svarende til tilfældet med alkener angiver navnene på alkyner den position, hvori carbon-carbon tredobbelt binding findes; for eksempel i tilfælde af HC2C-CHto-CH3, eller "1-butyne" og H3C-C2C-CH3, eller "2-butyne".
Ejendomme
Umættede kulbrinter består af et enormt antal forskellige molekyler, hvorfor de præsenterer en række egenskaber, der definerer dem, som er identificeret nedenfor:
Dobbelt og tredobbelt binding
De dobbelte og tredobbelte bindinger af alkener og alkyner har specielle egenskaber, der adskiller dem fra enkeltbindinger: en enkeltbinding repræsenterer den svageste af de tre, dannet af en sigmabinding mellem to molekyler.
Dobbeltbindingen er dannet af en sigma-binding og en pi, og den tredobbelte binding af en sigma-binding og to pi. Dette gør alkener og alkyner stærkere og kræver mere energi for at nedbrydes, når der opstår reaktioner..
Desuden er bindingsvinklerne, der dannes i en dobbeltbinding, 120º, mens de i den tredobbelte binding er 180 °. Dette betyder, at molekyler med tredobbelte bindinger har en lineær vinkel mellem disse to carbonatomer..
Cis-trans isomerisering
I alkener og andre forbindelser med dobbeltbindinger forekommer en geometrisk isomerisering, der adskiller sig på siden af bindingerne, hvori de funktionelle grupper, der er bundet til carbonerne involveret i denne dobbeltbinding, findes..
Når de funktionelle grupper af en alken er orienteret i samme retning med hensyn til dobbeltbindingen, kaldes dette molekyle cis, men når substituenterne er i forskellige retninger kaldes det trans.
Denne isomerisering er ikke en simpel forskel i placering; forbindelser kan variere meget, bare fordi de er cis-geometri eller trans-geometri.
Cis-forbindelser involverer normalt dipol-dipolkræfter (som har en nettoværdi på nul i transs); Derudover har de højere polaritet, kogepunkter og smeltepunkter og har højere densitet end deres trans-modstykker. Derudover er transforbindelser mere stabile og frigiver mindre forbrændingsvarme..
Surhed
Alkener og alkyner har højere surhed sammenlignet med alkaner på grund af polariteten af deres dobbelt- og tredobbeltbindinger. De er mindre sure end alkoholer og carboxylsyrer; og af de to er alkyner surere end alkener.
Polaritet
Polariteten af alkener og alkyner er lav, endnu mere i transalkenforbindelser, hvilket gør disse forbindelser uopløselige i vand..
Alligevel opløses umættede carbonhydrider let i almindelige organiske opløsningsmidler, såsom ethere, benzen, carbontetrachlorid og andre forbindelser med lav eller ingen polaritet..
Kogepunkter og smeltepunkter
På grund af deres lave polaritet er kogepunkterne og smeltepunkterne for umættede kulbrinter lave, næsten svarende til dem for alkaner, der har den samme kulstofstruktur..
Alligevel har alkener lavere kogepunkter og smeltepunkter end de tilsvarende alkaner, hvilket er i stand til at falde endnu mere, hvis de er cis-isomere, som tidligere nævnt..
I modsætning hertil har alkyner højere kogepunkter og smeltepunkter end alkaner og de tilsvarende alkener, selvom forskellen kun er et par grader..
Endelig har cycloalkener også lavere smeltetemperaturer end de tilsvarende cycloalkaner på grund af stivheden af dobbeltbindingen..
Eksempler
Ethylen (CtoH4)
En stærk kemisk forbindelse på grund af dens polymerisations-, oxidations- og halogeneringskapacitet, blandt andre egenskaber.
Ethyne (CtoHto)
Også kaldet acetylen, det er en brandfarlig gas, der bruges som en nyttig kilde til belysning og varme..
Propylen (C3H6)
Den næstmest anvendte forbindelse i den kemiske industri over hele verden, det er et af produkterne fra termolyse af råolie.
Cyclopenten (C5H8)
En forbindelse af cycloalkentypen. Dette stof bruges som en monomer til syntese af plast.
Artikler af interesse
Mættede kulbrinter eller alkaner.
Referencer
- Chang, R. (2007). Chemistry, niende udgave. Mexico: McGraw-Hill.
- Wikipedia. (s.f.). Alkenes. Hentet fra en.wikipedia.org
- Boudreaux, K. A. (s.f.). Umættede kulbrinter. Hentet fra angelo.edu
- Tuckerman, M. E. (s.f.). Alkenes og Alkynes. Hentet fra nyu.edu
- University, L. T. (s.f.). De umættede kulbrinter: Alkener og Alkyner. Hentet fra chem.latech.edu


Endnu ingen kommentarer