
Aluminiumhydroxidstruktur, egenskaber, anvendelser, risici
Det aluminiumhydroxid er en uorganisk forbindelse, hvis kemiske formel er Al (OH)3. I modsætning til andre metalhydroxider er det en amfoter, der er i stand til at reagere eller opføre sig som en syre eller en base afhængigt af mediet. Det er et hvidt fast stof, der er ganske uopløseligt i vand, så det finder anvendelse som en komponent i antacida.
Ligesom Mg (OH)to eller brucit, som den deler visse kemiske og fysiske egenskaber med, i ren form ligner det et kedeligt, amorft fast stof; men når det krystalliserer med nogle urenheder, får det krystallinske former som om de var perler. Blandt disse mineraler er naturlige kilder til Al (OH)3, gibbsite findes.

Ud over gibbsite er der også mineralerne bayerit, nordstrandit og doleyit, der udgør de fire polymorfe af aluminiumhydroxid. Strukturelt ligner de meget hinanden, og de er næppe forskellige i den måde, hvorpå lagene eller pladerne af ioner er placeret eller koblet, såvel som typen af urenheder indeholdt.
Ved at kontrollere pH- og synteseparametrene kan en hvilken som helst af disse polymorfe fremstilles. Nogle kemiske arter af interesse kan også interkaleres mellem dets lag, således at interkaleringsmaterialer eller forbindelser dannes. Dette repræsenterer brugen af en mere teknologisk tilgang til Al (OH)3. Dens andre anvendelser er som antacida.
På den anden side bruges det som råmateriale til opnåelse af aluminiumoxid, og dets nanopartikler er blevet brugt som en katalytisk bærer..
Artikelindeks
- 1 Struktur
- 1.1 Formel og oktaeder
- 1.2 Polymorfe
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Molær masse
- 2.3 Densitet
- 2.4 Smeltepunkt
- 2.5 Opløselighed i vand
- 2.6 Opløselighedsprodukt
- 2.7 Amfoterisme
- 3 Nomenklatur
- 4 anvendelser
- 4.1 Råmateriale
- 4.2 Katalytiske understøtninger
- 4.3 Interkaleringsforbindelser
- 4.4 Brandhæmmende
- 4.5 Lægemidler
- 4.6 Adsorbent
- 5 risici
- 6 Referencer
Struktur
Formel og oktaeder
Den kemiske formel Al (OH)3 angiver straks, at forholdet Al3+: OH- er 1: 3; der er tre OH-anioner- for hver Al-kation3+, hvilket er det samme som at sige, at en tredjedel af dets ioner svarer til aluminium. Al3+ og OH- interagerer elektrostatisk, indtil deres tiltrækningsafstødning definerer en sekskantet krystal.
Al3+ ikke nødvendigvis omgivet af tre OH- men seks; derfor taler vi om en koordineringsoktaeder, Al (OH)6, hvor der er seks Al-O-interaktioner. Hver oktaeder repræsenterer en enhed, hvormed krystallen er bygget, og et antal af dem vedtager trikliniske eller monokliniske strukturer.
Det nederste billede repræsenterer delvist Al (OH) octahedra6, da kun fire interaktioner observeres for Al3+ (lysebrune kugler).
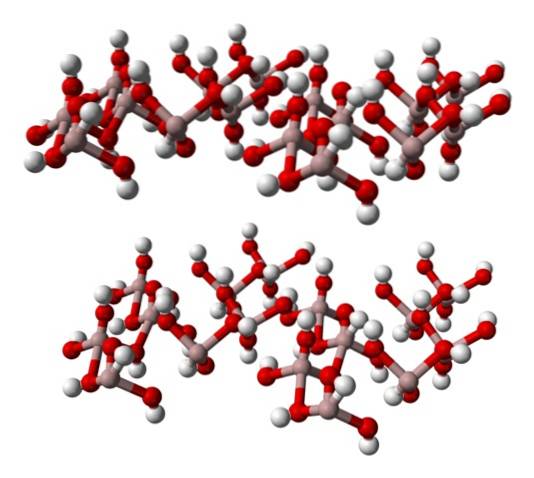
Hvis denne struktur overholdes nøje, hvilket svarer til mineralgibbsitets, kan det ses, at de hvide kugler udgør "ansigterne" eller overfladerne på ionlagene; disse er hydrogenatomerne i OH-ionerne-.
Bemærk også, at der er et lag A og et andet B (rumligt er de ikke identiske), forbundet sammen med hydrogenbindinger..
Polymorfe
Lag A og B er ikke altid koblet på samme måde, ligesom deres fysiske miljø eller værtsioner (salte) kan ændre sig. Derfor Al (OH) krystaller3 varierer i fire mineralogiske eller i dette tilfælde polymorfe former.
Aluminiumhydroxid siges derefter at have op til fire polymorfe: gibbsit eller hydrargillit (monoklinisk), bayerit (monoklinisk), doyleit (triklinik) og nordstrandit (triklinik). Af disse polymorfe er gibbsite den mest stabile og rigelige; de andre er klassificeret som sjældne mineraler.
Hvis krystallerne blev observeret under et mikroskop, ville det ses, at deres geometri er sekskantet (selvom det er noget uregelmæssig). PH spiller en vigtig rolle i væksten af sådanne krystaller og på den resulterende struktur; det vil sige, givet en pH-værdi, kan der dannes en polymorf eller en anden.
For eksempel hvis mediet hvor Al (OH) udfældes3 den har en pH-værdi, der er lavere end 5,8 gibbsite; mens hvis pH er højere end denne værdi, dannes bayerit.
I mere grundlæggende medier har nordstrandit- og doyleitkrystaller tendens til at dannes. At være den mest rigelige gibbsite er det således en kendsgerning, der afspejler surheden i dets forvitrede miljøer..
Ejendomme
Fysisk fremtoning
Hvidt fast stof, der kan komme i forskellige formater: granulat eller pulver og amorft i udseende.
Molar masse
78,00 g / mol
Massefylde
2,42 g / ml
Smeltepunkt
300 ° C Det har intet kogepunkt, fordi hydroxidet mister vand for at omdanne til aluminiumoxid eller aluminiumoxid, AltoELLER3.
Vandopløselighed
1 10-4 g / 100 ml. Opløseligheden stiger imidlertid med tilsætningen af syrer (H.3ELLER+) eller alkalier (OH-).
Opløselighedsprodukt
Ksp = 3 10−34
Denne meget lille værdi betyder, at kun en lille del opløses i vand:
Al (OH)3(s) <=> Til3+(aq) + 3OH-(ac)
Og faktisk gør denne ubetydelige opløselighed det til en god surhedsneutraliserende middel, da det ikke basiserer gastrisk miljø for meget, fordi det ikke frigiver næsten OH-ioner.-.
Amfoterisme
El Al (OH)3 det er præget af dets amfotere karakter; det vil sige, det kan reagere eller opføre sig som om det var en syre eller en base.
For eksempel reagerer det med H-ioner3ELLER+ (hvis mediet er vandigt) til dannelse af det vandige kompleks [Al (OHto)6]3+; som igen hydrolyseres for at forsure mediet, hvorfor Al3+ en sur ion:
Al (OH)3(s) + 3H3ELLER+(ac) => [Al (OHto)6]3+(ac)
[Al (OHto)6]3+(ac) + HtoO (l) <=> [Al (OHto)5(OH)]to+(ac) + H3ELLER+(ac)
Når dette sker, siges det, at Al (OH)3 opfører sig som en base, da den reagerer med H3ELLER+. På den anden side kan det reagere med OH-, opfører sig som en syre:
Al (OH)3(s) + OH-(ac) => Al (OH)4-(ac)
I denne reaktion det hvide bundfald af Al (OH)3 opløses over OH-ioner-; kendsgerning, der ikke sker det samme med andre hydroxider, såsom magnesium, Mg (OH)to.
El Al (OH)4-, alumination, kan udtrykkes mere hensigtsmæssigt som: [Al (OHto)to(OH)4]-, fremhævelse af koordinationsnummeret 6 for Al-kationen3+ (oktaederne).
Denne ion kan fortsætte med at reagere med mere OH- indtil afslutning af koordineringsoktaheder: [Al (OH)6]3-, kaldet hexahydroxoalumination.
Nomenklatur
Navnet 'aluminiumhydroxid', med hvilket der er henvist mere til denne forbindelse, svarer til det, der er reguleret af lagernomenklaturen. (III) er udeladt i slutningen af den, da oxidationstilstanden af aluminium er +3 i alle dens forbindelser.
De to andre mulige navne at henvise til Al (OH)3 De er: aluminiumtrihydroxid i henhold til den systematiske nomenklatur og brugen af de græske tællerpræfikser; og aluminiumhydroxid, der slutter med suffikset -ico for at have en enkelt oxidationstilstand.
Selv om nomenklaturen for Al (OH) inden for det kemiske felt3 repræsenterer ingen udfordring eller forvirring, uden for det har det en tendens til at blive blandet med uklarheder.
For eksempel er mineralet gibbsit en af de naturlige polymorfe af Al (OH)3, som de også navngiver som γ-Al (OH)3 eller α-Al (OH)3. Imidlertid α-Al (OH)3 kan også svare til mineralbayeritten eller β-Al (OH)3, ifølge krystallografisk nomenklatur. I mellemtiden betegnes polymorfene nordstrandite og doyleite normalt blot som Al (OH)3.
Følgende liste opsummerer klart det, der lige er blevet forklaret:
-Gibbsite: (γ eller α) -Al (OH)3
-Bayerit: (α eller β) -Al (OH)3
-Nordstrandite: Al (OH)3
-Doyleite: Al (OH)3
Ansøgninger
Råmateriale
Den umiddelbare anvendelse af aluminiumhydroxid er som et råmateriale til fremstilling af aluminiumoxid eller andre forbindelser, uorganiske eller organiske, af aluminium; for eksempel: AlCl3, Ved ikke3)3, AlF3 eller NaAl (OH)4.
Katalytiske understøtninger
Nanopartikler af Al (OH)3 de kan fungere som katalytiske bærere; dvs. katalysatoren slutter sig til dem for at forblive faste på deres overflade, hvor kemiske reaktioner accelereres.
Interkaleringsforbindelser
I afsnittet om strukturer blev det forklaret, at Al (OH)3 Den består af lag eller ark A og B, koblet til at definere en krystal. Inde i det er der små oktaedriske rum eller huller, der kan optages af andre ioner, metalliske eller organiske eller neutrale molekyler..
Når Al (OH) krystaller syntetiseres3 Med disse strukturelle modifikationer siges en interkaleringsforbindelse at blive fremstillet; det vil sige, de indsætter eller indsætter kemiske arter mellem ark A og B. Dermed fremkommer nye materialer fremstillet af dette hydroxid.
Brandhæmmende
El Al (OH)3 det er et godt brandhæmmende middel, der finder anvendelse som fyldstof til mange polymere matricer. Dette skyldes, at det absorberer varme for at frigive vanddamp, ligesom Mg (OH) gør.to eller brucita.
Medicinsk
El Al (OH)3 Det er også en neutraliserende surhedsgrad, der reagerer med HCI i gastrisk sekretion; igen, på samme måde som Mg (OH)to mælk af magnesia.
Begge hydroxider kan faktisk blandes i forskellige antacida, der bruges til at lindre symptomerne hos mennesker, der lider af gastritis eller mavesår..
Absorberende
Når det opvarmes under dets smeltepunkt, omdannes aluminiumhydroxid til aktiveret aluminiumoxid (såvel som aktivt kul). Dette faste stof anvendes som et adsorberende middel til uønskede molekyler, hvad enten det er farvestoffer, urenheder eller forurenende gasser..
Risici
De risici, som aluminiumhydroxid kan udgøre, skyldes ikke det som et fast stof, men som et lægemiddel. Det har ikke brug for nogen protokol eller regler for at gemme det, da det ikke reagerer kraftigt med oxidationsmidler, og det er ikke brandfarligt..
Når de indtages i antacida, der findes på apoteker, kan der forekomme uønskede bivirkninger, såsom forstoppelse og inhibering af fosfat i tarmene. På samme måde, og selvom der ikke er nogen undersøgelser, der kan bevise det, har det været forbundet med neurologiske lidelser såsom Alzheimers sygdom.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Aluminiumhydroxid. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Aluminiumhydroxid. PubChem-database. CID = 10176082. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Aluminiumhydroxid: Formel og bivirkninger. Undersøgelse. Gendannet fra: study.com
- Robert Schoen og Charles E. Roberson. (1970). Strukturer af aluminiumhydroxid og geokemiske implikationer. The American Mineralogist, bind 55.
- Vitaly P. Isupov & col. (2000). Syntese, struktur, egenskaber og anvendelse af aluminiumhydroxidinterkaleringsforbindelser. Kemi for bæredygtig udvikling 8.121-127.
- Narkotika. (24. marts 2019). Bivirkninger af aluminiumhydroxid. Gendannet fra: drugs.com



Endnu ingen kommentarer