
Kobber (II) hydroxidstruktur, egenskaber, nomenklatur, anvendelser

Det kobber (II) hydroxid o Cupric hydroxide er et lyseblåt eller blågrønt krystallinsk uorganisk fast stof, hvis kemiske formel er Cu (OH)to. Det opnås som et voluminøst blåt bundfald ved at tilsætte et alkalisk hydroxid til kobberopløsninger (det betyder, at de indeholder Cu-ionerto+). Det er en ustabil forbindelse.
For at øge dens stabilitet fremstilles den i nærværelse af ammoniak (NH3) eller fosfater Hvis det fremstilles i nærværelse af ammoniak, dannes et materiale med god stabilitet og stor partikelstørrelse.

Når den er fremstillet af kobber (II) phosphat, Cu3(PO4)to, der opnås et materiale med finere partikelstørrelse og større overfladeareal. Cuprichydroxid bruges i vid udstrækning som et fungicid og baktericid i landbruget og til behandling af træ og forlænger dets levetid..
Det bruges også som et kosttilskud til dyr. Det bruges som råmateriale til opnåelse af andre kobbersalte (II) og til galvanisering til overfladebehandling.
Undersøgelser er i gang for at estimere dets potentiale til at bekæmpe bakterie- og svampeinfektioner hos mennesker..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Tæthed
- 3.5 Opløselighed
- 3.6 Andre egenskaber
- 4 anvendelser
- 4.1 I landbruget
- 4.2 Ved konservering af træ
- 4.3 Ved fremstilling af rayon
- 4.4 I dyrefoderindustrien
- 4.5 Ved fremstilling af andre kobber (II) forbindelser
- 4.6 Andre anvendelser
- 4.7 Fremtidige medicinske anvendelser
- 5 Referencer
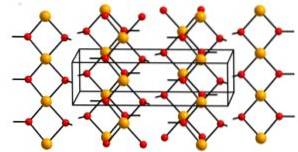
Struktur
Kobber (II) hydroxid indeholder uendelige kæder af kobberioner (Cuto+) bundet af broer af hydroxylgrupper (OH-).
Kæderne er pakket så, at 2 iltatomer fra andre kæder er over og under hvert kobberatom og antager således en forvrænget oktaedrisk konfiguration, som er almindelig i de fleste kobber (II) forbindelser..
I sin struktur er fire iltatomer i en afstand på 1,93 A; to iltatomer er ved 2,63 A; og Cu-Cu afstanden er 2,95 A..
Nomenklatur
- Kobber (II) hydroxid.
- Kobberhydroxid.
- Kobber dihydroxid.
Ejendomme
Fysisk tilstand
Krystallinsk fast stof.
Molekylær vægt
99,58 g / mol.
Smeltepunkt
Det nedbrydes inden smeltning. Nedbrydningspunkt 229 ºC.
Massefylde
3,37 g / cm3
Opløselighed
Det er næsten uopløseligt i vand: 2,9 mikrogram / l ved 25 ° C. Hurtigt opløselig i syrer, i koncentrerede alkaliske opløsninger og i ammoniumhydroxid. Uopløselig i organiske opløsningsmidler. I varmt vand nedbrydes det, hvilket genererer kobber (II) oxid, som er mere stabilt.
Andre egenskaber
Det er let opløseligt i stærke syrer og også i koncentrerede alkaliske hydroxidopløsninger for at give dybblå anioner, sandsynligvis af [Cun(OH)2n + 2]to-.
Dens stabilitet afhænger af fremstillingsmetoden.
Det kan nedbrydes, hvilket giver sort kobber (II) oxid (CuO), hvis det forbliver i ro i et par dage eller under opvarmning.
I nærvær af et overskud af alkali nedbrydes det over 50 ºC.
Ansøgninger
I landbruget
Kobber (II) hydroxid har en bred anvendelse som fungicid og antibakteriel i landbrugsafgrøder. Her er nogle eksempler:
- Det virker mod bakterielle pletter (af Erwinia) på salat, der anvendes som en bladbehandling.
- Mod bakterielle pletter (af Xanthomonas pruni) i ferskner, hvor der anvendes en sovende og bladbehandling.
- Det bruges mod blad- og stammedyr af blåbær gennem latente applikationer.
- Mod råd under opbevaring af blåbær forårsaget af Monilinia oxycocci, ved latent anvendelse.
Til anvendelse i landbruget anvendes kobber (II) hydroxid, som fremstilles i nærværelse af fosfater på grund af dets lille partikelstørrelse..

I konservering af træ
Træ er organisk og er følsomt over for angreb fra insekter og mikroorganismer. Kobber (II) hydroxid bruges som et biocid til svampe, der angriber træ.
Det bruges generelt sammen med en kvaternær ammoniumforbindelse (NH4+). Kobberhydroxidet fungerer som et fungicid, og den kvaternære ammoniumforbindelse fungerer som et insekticid..
På denne måde tåler eller modstår det behandlede træ servicevilkårene og når det ydelsesniveau, der kræves af brugeren. Træ behandlet med disse forbindelser har imidlertid et højt niveau af kobber og er meget ætsende over for almindeligt stål, så der kræves en type rustfrit stål, der kan modstå behandling af behandlet træ..
På trods af dets anvendelighed betragtes kobber (II) hydroxid som et let farligt biocid.
Af denne grund er der bekymring for, at det frigives fra behandlet træ i miljøet i mængder, der kan være skadelige for mikroorganismer, der er naturligt til stede i vand (floder, søer, vådområder og havet) eller jorden..
Ved fremstilling af rayon
Siden det 19. århundrede er ammoniakopløsninger af kobber (II) hydroxid blevet brugt til at opløse cellulose. Dette er et af de første skridt til at opnå fiberen kaldet rayon ved hjælp af teknologien udviklet af Bemberg i Tyskland..
Kobber (II) hydroxid opløses i en opløsning af ammoniak (NH3dannelse af et komplekst salt.
De raffinerede korte bomuldsfibre sættes til kobberammoniakopløsningen indeholdende kobber (II) hydroxidet som et udfældet fast stof..
Bomuldscellulose danner et kompleks med kobbertetra-ammoniumhydroxid, der opløses i opløsningen.
Denne opløsning koaguleres efterfølgende, mens den føres gennem en ekstruderingsindretning..
På grund af de høje omkostninger er denne teknologi allerede overgået af viskose. Bemberg-teknologi anvendes i øjeblikket kun i Japan.
I dyrefoderindustrien
Det bruges som spor i dyrefoder, da det er et af de stoffer, der kræves som mikronæringsstoffer til fuld ernæring af dyr.

Dette skyldes, at kobber i højere levende væsener er et væsentligt element, der kræves til aktiviteten af en række kobberholdige enzymer..
For eksempel er det indeholdt i det enzym, der deltager i produktionen af kollagen og i det enzym, der kræves til syntesen af melanin, blandt andre.
Det er en forbindelse, der generelt anerkendes som sikker, når den tilsættes i niveauer, der er i overensstemmelse med god spisepraksis..

Til fremstilling af andre kobber (II) forbindelser
Aktiv forløber til fremstilling af følgende kobber (II) forbindelser: kobber (II) naphthenat, kobber (II) 2-ethylhexanoat og kobbersæber. I disse tilfælde anvendes kobber (II) hydroxid, som syntetiseres i nærværelse af ammoniak..
Andre anvendelser
Det bruges til stabilisering af nylon, i batterielektroder; som farvefiksering ved farvning; som et pigment; i insekticider; til behandling og farvning af papir i katalysatorer som en katalysator ved vulkanisering af polysulfidgummi; som et antifouling pigment; og i elektrolyse, i galvanisering.
Fremtidige medicinske applikationer
Kobber (II) hydroxid er en del af kobberforbindelserne, der undersøges i form af nanopartikler til eliminering af bakterier såsom E coli, K. pneumoniae, P. aeruginosa, Salmonella spp., blandt andet forårsager sygdomme hos mennesker.
Det har også vist sig, at nanopartikler af kobber kan være effektive mod Candida albicans, en svamp, der er en almindelig årsag til menneskelige patologier.
Dette indikerer, at kobbernanoteknologi kan spille en vigtig rolle mod bakterier og svampe, der forårsager infektioner hos mennesker, og kobber (II) hydroxid kan være meget nyttigt inden for disse områder..
Referencer
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Bind 7. fjerde udgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte udgave. Bind A7. VCH Verlagsgesellschaft mbH.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm og Trotman-Dickenson, A.F. (1973). Omfattende uorganisk kemi. Volumen 3. Pergamon Press.
- National Library of Medicine. (2019). Kobber (II) hydroxyde. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Schiopu, N. og Tiruta-Barna, L. (2012). Træbeskyttelsesmidler. I toksicitet af byggematerialer. Kapitel 6. Gendannet fra sciencedirect.com.
- Mordorski, B. og Friedman, A. (2017). Metal nanopartikler til mikrobiel infektion. I funktionaliserede nanomaterialer til styring af mikrobiel infektion. Kapitel 4. Gendannet fra sciencedirect.com.
- Takashi Tsurumi. (1994). Løsning spinding. I avanceret fiber spinning teknologi. Kapitel 3. Gendannet fra sciencedirect.com.



Endnu ingen kommentarer