
Nikkel (III) hydroxidstruktur, egenskaber, anvendelser, risici

Det nikkel (III) hydroxid Det er en uorganisk forbindelse, hvor nikkelmetal har et oxidationsnummer på 3+. Dens kemiske formel er Ni (OH)3. Ifølge de hørte kilder har det indtil nu ikke været muligt at kontrollere eksistensen af nikkel (III) hydroxid Ni (OH)3, men det har været muligt at opnå nikkel (III) oxo-hydroxid, NiO (OH).
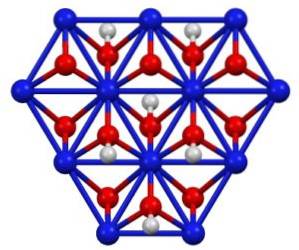
Nikkel (III) oxohydroxid NiO (OH) er et sort krystallinsk fast stof, der krystalliserer i to former: beta- og gamma-formerne. Den mest almindelige krystallinske form af NiO (OH) er beta.
NiO (OH) kan opnås ved oxidation af nikkel (II) nitratopløsninger (Ni (NO3)tomed chlor (Clto) eller brom (Brto) i nærværelse af kaliumhydroxid (KOH). Nikkel (III) oxohydroxid er meget opløseligt i syrer. Det kan anvendes i nikkelbatterier, i superkondensatorer og som en regenererbar katalysator.
Nikkel (III) oxo-hydroxid NiO (OH) og nikkel (II) hydroxid Ni (OH)to er forenet i driften af de fleste af deres applikationer, da begge er en del af den samme oxidreduktionsligning.
At være en nikkelforbindelse udgør NiO (OH) de samme risici som andre nikkelsalte, det vil sige hudirritation eller dermatitis og kræft.
Artikelindeks
- 1 Krystalstruktur
- 2 Elektronisk konfiguration
- 3 Nomenklatur
- 4 egenskaber
- 4.1 Fysisk tilstand
- 4.2 Opløselighed
- 4.3 Andre egenskaber
- 5 anvendelser
- 5.1 I nikkelbatterier
- 5.2 I elektrokatalyse som en regenererbar katalysator
- 5.3 I superkondensatorer
- 5.4 Ved oxidation af metalioner
- 6 risici
- 7 Referencer
Krystalstruktur
Nikkel (III) oxohydroxid krystalliserer i to former: beta og gamma. Beta-formen β-NiO (OH) har en meget lignende struktur til β-Ni (OH)to, hvilket synes logisk, da førstnævnte kommer fra oxidationen af sidstnævnte.
Gamma γ-NiO (OH) -formen er oxidationsproduktet af nikkel (II) hydroxid i sin alfa-form, α-Ni (OH)to. Ligesom sidstnævnte har gamma en lagdelt struktur med alkalimetalioner, anioner og vand spredt mellem lagene..
Elektronisk konfiguration
I NiO (OH) er nikkel i 3+ oxidationstilstand, hvilket betyder, at dets yderste lag mangler 3 elektroner, dvs. to elektroner mangler fra lag 4s og en elektron fra skal 3d. Elektronkonfigurationen af Ni3+ i NiO (OH) er det: [Ar] 3d7, hvor [Ar] er elektronkonfigurationen af ædelgasargonen.
Nomenklatur
- NiO (OH): Nikkel (III) oxohydroxid
- Nikkel sort
Ejendomme
Fysisk tilstand
Sort krystallinsk fast stof.
Opløselighed
NiO (OH) oxohydroxid er meget opløseligt i syrer. Gamma-fasen opløses i svovlsyre med iltudvikling.
Andre egenskaber
I varmt vand bliver det nikkel (II) og (III) oxohydroxid, Ni3ELLERto(OH)4.
Det nedbrydes ved 140 ºC i nikkel (II) oxid (NiO), vand og ilt.
Gamma-fasen (γ-NiO (OH)) kan opnås på forskellige måder, fx ved behandling af nikkel med en smeltet blanding af natriumperoxid (Na2).toELLERto) og natriumhydroxid (NaOH) ved 600 ºC og afkøling i isvand.
Gamma-fasen nedbrydes ved opvarmning til 138 ºC.
Ansøgninger
I nikkelbatterier
Edisons nikkel-jernbatteri, hvor KOH bruges som elektrolyt, er baseret på reaktionen mellem nikkel (III) oxohydroxid og jern:
Hent:
Fe + 2NiO (OH) + HtoO ⇔ Fe (OH)to + 2Ni (OH)to
Belastning:
Det er en reversibel oxidationsreduktionsreaktion.
En række kemiske og elektrokemiske processer finder sted ved anoderne på disse batterier. Her er en generel oversigt:
Hent
β-Ni (OH)to ⇔ β-NiO (OH) + H+ + og-
belastning
Aldring ↑ ↓ Overbelastning
Hent
α-Ni (OH)to ⇔ γ-NiO (OH) + H+ + og-
belastning
I nikkelbatteriteknologi kaldes nikkel (III) oxohydroxid NiO (OH) "aktiv nikkelmasse".

I elektrokatalyse som en regenererbar katalysator
NiO (OH) er blevet anvendt med succes i elektrosyntesen af azopyrazoler gennem den elektrokatalytiske oxidation af aminopyrazoler. Dens anvendelighed ved syntesen af carboxylsyrer startende fra alkoholer eller carbonylforbindelser er også blevet bevist..

Et andet eksempel er den kvantitative omdannelse af hydroxymethylpyridin til en pyridincarboxylsyre. I dette tilfælde er stål- eller nikkelelektroden svarende til anoden dækket med et lag af NiO (OH). Mediet, i hvilket elektrolysen udføres, er alkalisk.
I disse reaktioner fungerer NiO (OH) som en reduktionsoxidationsmægler eller "redox" -mægler..
Elektrolysen udføres i en celle med nikkelanode og titankatode i et alkalisk medium. Ni (OH) dannes under processento på overfladen af nikkelanoden, som hurtigt oxideres til NiO (OH):
Ni (OH)to + Åh- - og- ⇔ NiO (OH) + HtoELLER
NiO (OH) reagerer med det organiske substrat, og det ønskede organiske produkt opnås, regenererende Ni (OH)to:
NiO (OH) + organisk forbindelse → Ni (OH)to + produkt
Når Ni (OH) regenerererto, katalysereaktionen fortsættes.
Anvendelsen af NiO (OH) som en elektrokatalysator muliggør opnåelse af organiske forbindelser med lave omkostninger og på en miljøvenlig måde.
I superkondensatorer
NiO (OH) sammen med Ni (OH)to lav fremragende materialer til superkondensatorelektroder. superkondensatorer).
Ni (OH)to + Åh- ⇔ NiO (OH) + HtoO + e-
De har høj kapacitans, lave omkostninger og ifølge nogle referencer lav miljøpåvirkning.

De har dog lav ledningsevne. Dette løses ved anvendelse af nanopartikler af de nævnte forbindelser, da dette øger overfladearealet og formindsker den nødvendige afstand til diffusion, hvilket sikrer en høj overførselshastighed for elektroner og / eller ioner..
I oxidation af metalioner
En af de kommercielle anvendelser af nikkel (III) oxohydroxid er baseret på dets evne til at oxidere cobalt (II) -ioner i opløsning til cobalt (III) -ioner..
Risici
Nikkel i opløsning er mere stabil som Ni-ionto+, derfor er det ikke almindeligt at komme i kontakt med Ni-løsninger3+. Forholdsreglerne er imidlertid de samme, da nikkel, hvad enten det er metallisk, i opløsning eller i form af dets faste salte, kan forårsage hudsensibilisering..
Det tilrådes at bruge beskyttelsesudstyr og tøj såsom ansigtsskærm, handsker og sikkerhedssko. Alt dette skal bruges, når der er mulighed for at komme i kontakt med nikkelopløsninger..
Hvis dermatitis opstår, skal den behandles med en læge for at udelukke, at den er forårsaget af nikkel..
Med hensyn til muligheden for inhalation er det god praksis at holde luftbårne koncentrationer af nikkelsaltstøv meget lave ved hjælp af lokal ventilation og at bruge åndedrætsværn, når det er nødvendigt..
Alle nikkelforbindelser er klassificeret af Det Internationale Agentur for Kræftforskning eller IARC. International Agency for Research on Cancer), i kategorien kræftfremkaldende stoffer til mennesker.
Dette er baseret på epidemiologiske og eksperimentelle data.
Referencer
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Lyalin, B.V. et al. Elektrosyntese af azopyrazoler via oxidation af N-alkylaminopyrazoler på en NiO (OH) anode i vandig alkali - En grøn metode til N-N homokobling. Tetrahedron Letters. 59 (2018) 2741-2744. Gendannet fra sciencedirect.com.
- Liuyang, Zhang, et al. (2018). Nikkelbaserede materialer til superkondensatorer. Materialer i dag. Gendannet fra sciencedirect.com
- Ettel, V.A. og Mosolu, M. A. (1977). Forberedelse af nikkel sort. OS. Patent nr. 4,006,216. 1. februar 1977.
- Scharbert, B. (1993). Fremgangsmåde til oxidation af hydroxymethylpyridinderivater til pyridincarboxylsyrederivater ved nikkeloxidhydroxidanoder. OS. Patent nr. 5.259.933. 9. november 1993.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Bind 17. fjerde udgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte udgave. Bind A 17. VCH Verlagsgesellschaft mbH.
- McBreen, James. (1997). Nikkelhydroxider. I håndbogen med batterimaterialer. VCH Publisher. Gendannet fra osti.gov.


Endnu ingen kommentarer