
Histones karakteristika, struktur, typer og funktioner
Det histoner er basiske proteiner, der interagerer med DNA til dannelse af nukleosomer, som udgør kromatinstrengene, der udgør kromosomer i eukaryote organismer.
Nukleosomer, komplekser, der består af DNA og proteiner, blev opdaget i 1974, og det er histoner, der samler dette basale niveau af kromatinorganisation. Imidlertid har eksistensen af histonproteiner været kendt siden før 1960'erne..
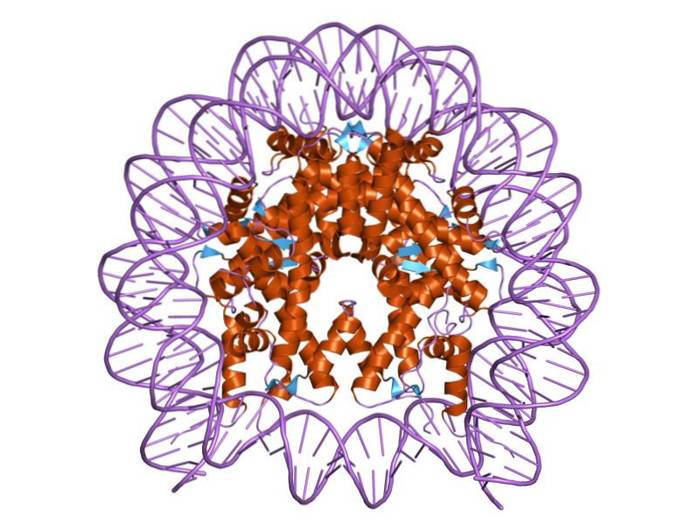
Histoner er organiseret på en sådan måde, at dobbeltbånds-DNAet vikles rundt om et proteincenter, der består af disse proteiner, der interagerer tæt med hinanden. Histonecentret er formet som en skive, og DNA går omkring 1,7 gange omkring det..
Flere hydrogenbindinger tillader DNA at binde sig til proteincentret dannet af histonerne i hvert nukleosom. Disse bindinger dannes for det meste mellem aminosyre-rygraden i histoner og sukker-phosphat-rygraden i DNA. Nogle hydrofobe interaktioner og ionbindinger deltager også.
Proteiner kendt som "chromatin remodeling complexes" er ansvarlige for nedbrydningen og dannelsen af forbindelsesbindingerne mellem DNA og histoner, hvilket tillader indgang af transkriptionsmaskineriet i DNA indeholdt i nukleosomerne.
På trods af nærheden af nukleinsyrer til det proteincenter, der dannes af histoner, er disse arrangeret på en sådan måde, at de, hvis det er nødvendigt, tillader indgang af transkriptionsfaktorer og andre proteiner relateret til genekspression eller gendæmpning..
Histoner kan gennemgå forskellige ændringer, der genererer flere varianter, hvilket muliggør eksistensen af mange forskellige former for kromatin, der har den egenskab at modulere genetisk ekspression på forskellige måder..
Artikelindeks
- 1 Funktioner
- 2 Struktur
- 2.1 Bindende histoner
- 3 typer
- 3.1 Nukleosomale histoner
- 3.2 Bindende histoner
- 4 funktioner
- 5 Referencer
Egenskaber
De er et af de mest konserverede eukaryote proteiner i naturen. For eksempel er det vist, at ærthiston H4 adskiller sig i kun to af de 102 aminosyrepositioner i ko-H4-proteinet..
Histoner er relativt små proteiner med ikke mere end 140 aminosyrer. De er rige på basiske aminosyrerester, så de har en nettopositiv ladning, som bidrager til deres interaktion med den negativt ladede nukleinsyre til dannelse af nukleosomer..
Nukleosomale og brodannende histoner er kendt. De nukleosomale histoner er H3, H4, H2A og H2B, mens bindingshistonerne hører til familien af histoner H1.
Under nukleosomsamling dannes oprindeligt specifikke dimerer H3-H4 og H2A-H2B. To H3-H4-dimerer slutter sig derefter sammen til dannelse af tetramerer, der senere kombineres med H2A-H2B-dimerer og danner det oktameriske centrum..
Alle histoner syntetiseres hovedsageligt under S-fasen af cellecyklussen, og nukleosomer samles i de spirende DNA-spiraler lige efter replikationsgaffelen..
Struktur
Den generelle struktur af histoner inkluderer en basisk aminosyreregion og en kugleformet carboxylregion, der er stærkt konserveret blandt eukaryote organismer..
Et strukturelt motiv kendt som "histonfoldning", der består af tre alfa-helixer forbundet med to hårnåle og danner et lille hydrofobt center, er ansvarlig for protein-protein-interaktioner mellem de histoner, der udgør nukleosomet..
Det er denne fold af histoner, der udgør det kugleformede carboxyldomæne af disse nukleosomale proteiner i alle eukaryoter..
Histoner har også små "haler" eller aminoterminale og andre carboxylterminale regioner (tilgængelige for proteaser), ikke mere end 40 aminosyrer lange. Begge regioner er rige på basiske aminosyrer, der kan gennemgå flere post-translationelle kovalente ændringer..
Bindende histoner
I eukaryoter er der to familier af bindende histoner, der adskiller sig fra hinanden ved deres struktur. Nogle har en tredelt struktur med det ovenfor beskrevne kugleformede domæne flankeret af "ustrukturerede" N- og C-terminale domæner; mens andre kun har et C-terminal domæne.
Selvom de fleste histoner er konserverede, kan der opstå specifikke varianter under embryogenese eller modning af specialiserede celler i nogle organismer. Nogle strukturelle variationer har at gøre med post-translationelle ændringer som følgende:
-Fosforylering: det menes at være relateret til ændringen af graden af kondensation af kromatin, og det forekommer almindeligvis i serinrester.
-Acetylering: forbundet med kromosomale regioner, der er transkriptionelt aktive. Det forekommer normalt på sidekæderne af lysinrester. Når de forekommer på disse rester, falder deres positive ladning, hvorved proteins affinitet for DNA mindskes..
-Methylering: kan forekomme som mono-, di- eller trimethylering af lysinrester, der stikker ud fra proteinkernen.
Specifikke enzymer er ansvarlige for disse kovalente ændringer i histoner. Disse enzymer inkluderer histon-acetyltransferaser (HAT'er), histondeacetylasekomplekser (HDAC'er) og histon-methyltransferaser og demethylaser..
Typer
Karakteriseringen af histonerne er blevet udført ved forskellige biokemiske teknikker, blandt hvilke kromatografierne, der er baseret på svage kationbytterharpikser, skiller sig ud..
Visse forfattere etablerer en form for klassificering, hvor der skelnes mellem 5 hovedtyper af histoner i eukaryoter: FI med 21 kDa proteiner; F2A1 eller FIV, på plus eller minus 11,3 kDa; F2A2 eller FIIbI, 14,5 kDa; F2B eller FIIb2 med en molekylvægt på 13,7 kDa og F3 eller FIII på 15,3 kDa.
Alle disse typer histoner, med undtagelse af IF-gruppen, findes i ækvimolære mængder i celler..
En anden klassifikation, med den samme gyldighed og måske den mest anvendte i dag, foreslår eksistensen af to forskellige typer histoner, nemlig: dem, der er en del af nukleosomets octamer og bindings- eller brohistonerne, som forbinder nukleosomerne mellem Ja.
Nogle varianter kan også forekomme mellem arter, og i modsætning til kernehistoner syntetiseres varianter under interfase og indsættes i det præformede kromatin gennem en proces, der er afhængig af den energi, der frigøres fra ATP-hydrolyse..
Nukleosomale histoner
Midten af et nukleosom består af et par af hver af de fire sammensatte histoner: H2a, H2b, H3 og H4; på hvilke DNA-segmenter på ca. 145 basepar er viklet.
Histoner H4 og H2B er i princippet uforanderlige. Nogle variationer er imidlertid tydelige i histoner H3 og H2A, hvis biofysiske og biokemiske egenskaber ændrer den normale natur af nukleosomet..
En variant af histon H2A hos mennesker, H2A.Z-proteinet har en stor sur region og kan fremme nukleosomstabilitet afhængigt af histon H3-varianterne, som det er forbundet med..
Disse histoner viser visse variationer mellem arter, et specielt tilfælde er histon H2B, for hvilken den første tredjedel af molekylet er meget variabel..
Bindende histoner
Bindings- eller brohistonerne er klasse H1-histoner. Disse er ansvarlige for foreningen mellem nukleosomer og beskyttelsen af DNA'et, der stikker ud i begyndelsen og i slutningen af hver partikel..
I modsætning til nukleosomale histoner besidder ikke alle H1-type histoner den kugleformede region af histon "fold". Disse proteiner binder til DNA mellem nukleosomer, hvilket letter en forskydning i kromatinbalance mod en mere kondenseret og mindre aktiv tilstand, transkriptionelt set..
Undersøgelser har knyttet disse histoner til aldring, DNA-reparation og apoptotiske processer, hvorfor de menes at spille en afgørende rolle i opretholdelsen af genomisk integritet.
Funktioner
Alle aminosyrerester af histoner deltager på en eller anden måde i deres interaktion med DNA, hvilket forklarer det faktum, at de er så konserverede blandt kongedømmene i eukaryote organismer.
Deltagelse af histoner i emballering af DNA i form af kromatin er af stor relevans for komplekse flercellede organismer, hvor de forskellige cellelinjer kun kan specialisere sig ved at ændre tilgængeligheden af deres gener til transkriptionsmaskineriet..
Transkriptionelt aktive genomiske regioner er tætte i nukleosomer, hvilket antyder, at associering af DNA med histonproteiner er afgørende for den negative eller positive regulering af deres transkription..
Ligeledes afhænger responsen på et stort antal stimuli, både internt og eksternt, gennem en celles levetid af små ændringer i kromatin, som normalt har at gøre med ombygning og post-translationel modifikation af histonerne, der findes i tæt forhold til DNA.
Flere histonvariabler tjener forskellige funktioner i eukaryoter. En af dem har at gøre med deltagelse af en variant af histon H3 i dannelsen af de centromere strukturer, der er ansvarlige for adskillelsen af kromosomer under mitose..
Modstykket til dette protein i andre eukaryoter har vist sig at være essentielt for samling af proteinkinetokoren, hvortil spindelmikrotubuli binder under mitose og meiose..
Referencer
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2015). Molecular Biology of the Cell (6. udgave). New York: Garland Science.
- Campos, E. I., og Reinberg, D. (2009). Histoner: Annotering af kromatin. Annu. Præsten Genet., 43, 559-599.
- Harvey, A. C., & Downs, J. A. (2004). Hvilke funktioner indeholder linkerhistoner? Molekylær mikrobiologi, 53, 771-775.
- Henikoff, S., & Ahmad, K. (2005). Samling af varianthistoner i kromatin. Annu. Præsten Cell. Dev. Biol., enogtyve, 133-153.
- Isenberg, I. (1979). Histoner. Annu. Præsten Biochem., 48, 159-191.
- Kornberg, R. D., & Thomas, J. O. (1974). Kromatinstruktur: Oligomerer af histonerne. Videnskab, 184(4139), 865-868.
- Smith, E., DeLange, R., & Bonner, J. (1970). Histones kemi og biologi. Fysiologiske anmeldelser, halvtreds(2), 159-170.

Endnu ingen kommentarer