
Charles Law formler og enheder, eksperiment, øvelser
Det charles lov eller Guy-Lussac er en, der tillader angivelse af en af egenskaberne for den gasformige tilstand: det volumen, som en gas optager, er direkte proportional med temperaturen ved konstant tryk.
Denne proportionalitet er lineær for alle temperaturområder, hvis den pågældende gas er ideel; reelle gasser afviger derimod fra den lineære tendens ved temperaturer nær deres dugpunkt. Dette har dog ikke begrænset brugen af denne lov til et utal af applikationer, der involverer gasser..

En af de væsentligste anvendelser af Charles's lov er i luftballoner. Andre enklere balloner, såsom de ønsker, også kaldet kinesiske lanterner (øverste billede), afslører forholdet mellem volumen og temperaturen på en gas ved konstant tryk.
Hvorfor ved konstant pres? For hvis trykket skulle øges, ville det betyde, at beholderen, hvor gassen befinder sig, er lukket hermetisk; og med dette ville kollisionerne eller påvirkningerne af de gasformige partikler mod beholderens indre vægge øges (Boyle-Mariotte-loven).
Derfor ville der ikke være nogen ændring i det volumen, der optages af gassen, og Charles lov mangler. I modsætning til en lufttæt beholder repræsenterer stoffet i ønsket om balloner en mobil barriere, der er i stand til at ekspandere eller trække sig sammen afhængigt af det tryk, der udøves af gassen indeni..
Da ballonens væv udvides, forbliver det indre tryk i gassen imidlertid konstant, fordi det område, hvor dets partikler kolliderer, stiger. Jo højere gastemperaturen er, jo højere er partiklernes kinetiske energi og derfor antallet af kollisioner.
Og når ballonen udvides igen, forbliver kollisionerne mod dens indre vægge (ideelt set) konstante..
Så jo varmere gassen er, desto større ekspansion af ballonen og jo højere vil den stige. Resultatet: rødlige (omend farlige) lys hængende op på himlen på decembernætter..
Artikelindeks
- 1 Hvad er Charles's lov?
- 1.1 Erklæring
- 1.2 Job
- 1.3 Graf
- 2 Formler og måleenheder
- 2.1 Formler
- 2.2 Enheder
- 3 Eksperiment for at bevise loven
- 3.1 Montering
- 3.2 Udvikling
- 3.3 Ballon med is om vinteren
- 4 Løst øvelser
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 4.3 Øvelse 3
- 5 applikationer
- 5.1 Balloner af ønsker
- 5.2 Pop-up- eller kalkuntermometre
- 5.3 Gendannelse af ping-pong-kuglerne
- 5.4 Klargøring af brødene
- 6 Referencer
Hvad er Charles's lov?
Udmelding
Den såkaldte Charles Law eller Gay-Lussac's lov forklarer den afhængighed, der findes mellem volumen optaget af en gas og værdien af dens absolutte temperatur eller Kelvin-temperatur..
Loven kan anføres som følger: hvis trykket forbliver konstant, følger det, at ”for en given masse af en gas øger den sit volumen med ca. 1/273 gange dets volumen ved 0 ºC, for hver grad celsius (1 ºC) for at øge temperaturen ".
Job
Forskningsarbejdet, der etablerede loven, blev startet i 1780'erne af Jacques Alexander Cesar Charles (1746-1823). Dog offentliggjorde Charles ikke resultaterne af sin forskning..
Senere lykkedes det John Dalton i 1801 at bestemme eksperimentelt, at alle gasser og dampe, undersøgt af ham, ekspanderer mellem to bestemte temperaturer i samme volumenmængde. Disse resultater blev bekræftet af Gay-Lussac i år 1802.
Forskningsarbejderne fra Charles, Dalton og Gay-Lussac tillod at fastslå, at volumen optaget af en gas og dens absolutte temperatur er direkte proportional. Derfor er der en lineær sammenhæng mellem temperaturen og volumenet af en gas.
Kurve
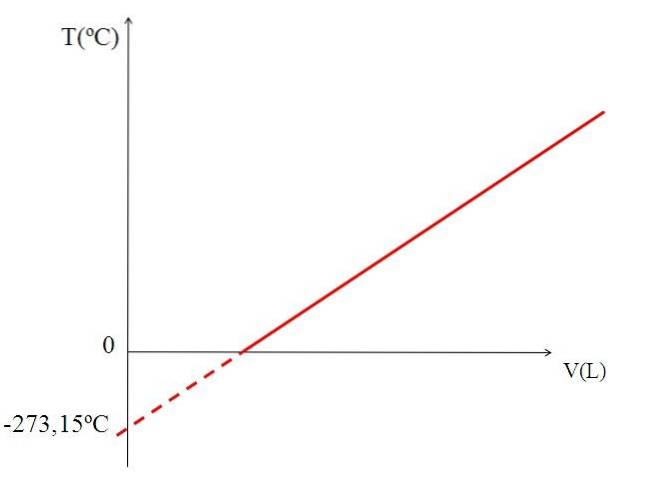
Grafering (øverste billede) volumen af en gas versus temperatur giver en lige linje. Krydsningen af linjen med X-aksen ved en temperatur på 0 ºC muliggør opnåelse af gasens volumen ved 0 º C.
Ligeledes ville skæringspunktet mellem linjen og X-aksen give information om den temperatur, for hvilken volumenet optaget af gassen ville være nul "0". Dalton estimerede denne værdi til -266 ºC, tæt på den værdi, som Kelvin foreslog for absolut nul (0).
Kelvin foreslog en temperaturskala, hvis nul skulle være den temperatur, hvor en perfekt gas ville have et volumen på nul. Men ved disse lave temperaturer flydes gasserne.
Derfor er det ikke muligt at tale om gasmængder som sådan, idet man finder, at værdien for absolut nul skal være -273,15 ºC.
Formler og måleenheder
Formler
Charles 'lov i sin moderne version siger, at volumen og temperatur på en gas er direkte proportional.
Derefter:
V / T = k
V = gasvolumen. T = Kelvin temperatur (K). k = proportionalitetskonstant.
For et volumen V1 og en temperatur T1
k = V1 / T1
Ligeledes for et volumen Vto og en temperatur Tto
k = Vto / Tto
Derefter svarer vi til de to ligninger for k, vi har
V1 / T1 = Vto / Tto
Denne formel kan skrives som følger:
V1 Tto = Vto T1
Løsning for Vto, du får formlen:
Vto = V1 Tto / T1
Enheder
Gasens volumen kan udtrykkes i liter eller i en hvilken som helst af dens afledte enheder. På samme måde kan lydstyrken udtrykkes i kubikmeter eller i en hvilken som helst afledt enhed. Temperaturen skal udtrykkes i absolut temperatur eller Kelvin temperatur.
Så hvis temperaturen på en gas er udtrykt i grader Celsius eller Celsius-skalaen, for at udføre en beregning med dem, skal mængden på 273,15 ºC føjes til temperaturerne for at bringe dem til absolutte temperaturer eller kelvin..
Hvis temperaturerne udtrykkes i grader Fahrenheit, ville det være nødvendigt at tilføje 459,67 ºR til disse temperaturer for at bringe dem til absolutte temperaturer på Rankine-skalaen..
En anden velkendt formel i Charles's Law, og som er direkte relateret til dens erklæring, er følgende:
Vt = Veller (1 + t / 273)
Hvor Vt er det volumen, der optages af en gas ved en bestemt temperatur, udtrykt i liter, cm3, etc.; og Veller er volumen optaget af en gas ved 0 ºC. For sin del er t den temperatur, hvor lydstyrken måles, udtrykt i grader celsius (ºC).
Og endelig repræsenterer 273 værdien af absolut nul på Kelvin temperaturskalaen.
Eksperiment for at bevise loven
Montering
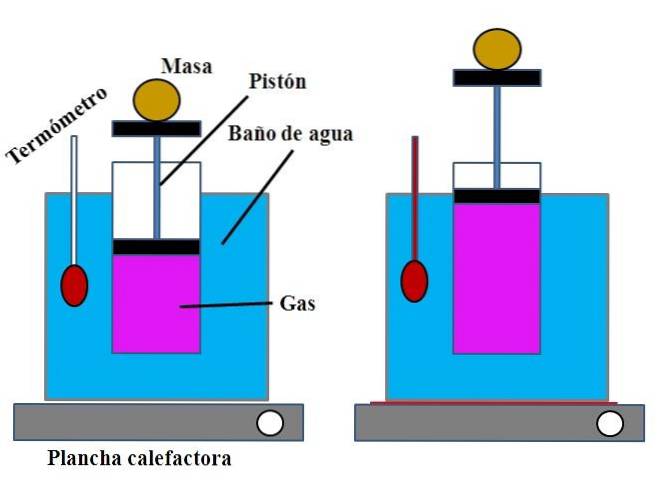
I en vandbeholder, der opfyldte funktionen af et vandbad, blev en åben cylinder placeret øverst med et stempel, der passer til cylinderens indre væg (øverste billede).
Dette stempel (bestående af stemplet og de to sorte baser) kunne bevæge sig mod toppen eller bunden af cylinderen afhængigt af mængden af gas, den indeholdt..
Vandbadet kunne opvarmes ved hjælp af en brænder eller et varmeanlæg, der leverede den nødvendige varme til at øge temperaturen på badet og derfor temperaturen på cylinderen udstyret med et stempel..
En bestemt masse blev anbragt på stemplet for at sikre, at eksperimentet blev udført ved konstant tryk. Badets og cylinderens temperatur blev målt ved anvendelse af et termometer anbragt i vandbadet..
Selvom cylinderen sandsynligvis ikke havde en gradering for at visualisere luftvolumen, kunne dette estimeres ved at måle den højde, der er nået af massen placeret på stemplet og overfladen af cylinderens bund..
Udvikler
Volumenet af en cylinder opnås ved at multiplicere overfladearealet på dens base med dens højde. Overfladen på cylinderbasen kunne opnås ved at anvende formlen: S = Pi x rto.
Mens højden opnås ved at måle afstanden fra bunden af cylinderen til den del af stemplet, hvor massen hviler.
Da temperaturen i badet blev øget af varmen, der blev produceret af tænderen, blev stemplet observeret at stige inde i cylinderen. Derefter læser de på termometeret temperaturen i vandbadet, der svarer til temperaturen inde i cylinderen..
Ligeledes målte de højden af massen over stemplet og var i stand til at estimere det luftvolumen, der svarede til den målte temperatur. På denne måde foretog de flere målinger af temperaturen og estimater af volumenet af luft svarende til hver af temperaturerne..
Med dette var det endelig muligt at fastslå, at det volumen, som en gas optager, er direkte proportionalt med dens temperatur. Denne konklusion tillod at uddybe den såkaldte Charles-lov.
Ballon med is om vinteren
Ud over det forrige eksperiment er der en enklere og mere kvalitativ: ballon med is om vinteren..
Hvis en heliumfyldt ballon blev placeret i et opvarmet rum om vinteren, ville ballonen have et bestemt volumen; Men hvis det senere blev flyttet til ydersiden af huset med en lav temperatur, ville det bemærkes, at heliumballonen krymper og reducerer dens volumen ifølge Charles's Law.
Løst øvelser
Øvelse 1
Der er en gas, der optager et volumen på 750 cm3 ved 25 ºC: hvad vil det volumen være, som denne gas optager ved 37 ºC, hvis trykket holdes konstant?
Det er nødvendigt først at omdanne temperaturenhederne til kelvin:
T1 i Kelvin grader = 25 ºC + 273,15 ºC = 298,15 K
Tto i Kelvin grader = 37 ºC + 273,15 ºC = 310,15 K
Fordi V1 og de andre variabler, vi løser for Vto og beregnes med følgende ligning:
Vto = V1 · (Tto / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Øvelse 2
Hvad ville temperaturen være i grader Celsius, hvor 3 liter af en gas skulle opvarmes til 32 ºC, så dens volumen udvides til 3,2 liter?
Igen omdannes graderne til kelvin:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Og som i den forrige øvelse ryddes Tto i stedet for Vto, og beregnes nedenfor:
Tto = Vto · (T1 / V1)
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Men erklæringen beder om grader Celsius, så T-enheden ændresto:
Tto i grader celsius = 325, 49 º C (K) - 273,15 ºC (K)
= 52,34 ºC
Øvelse 3
Hvis en gas ved 0 ºC optager et volumen på 50 cm3, Hvilket volumen optager det ved 45 ºC?
Brug af den oprindelige formel til Charles lov:
Vt = Veller (1 + t / 273)
Vi fortsætter med at beregne Vt direkte, da alle variabler er tilgængelige:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
På den anden side, hvis problemet løses ved hjælp af strategien i eksempel 1 og 2, har vi:
Vto = V1 · (Tto / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Resultatet ved anvendelse af de to procedurer er det samme, fordi de i sidste ende er baseret på det samme princip i Charles's lov.
Ansøgninger
Ønsk balloner
Ønskeballonerne (allerede nævnt i indledningen) er udstyret med et tekstilmateriale imprægneret med en brændbar væske.
Når dette materiale tændes, er der en stigning i temperaturen på luften i ballonen, hvilket medfører en stigning i gasvolumenet i henhold til Charles lov..
Derfor øges tætheden af luften i den ved at øge volumenet af luft i ballonen, hvilket bliver mindre end densiteten af den omgivende luft, og det er grunden til, at ballonen stiger.
Pop-up- eller kalkuntermometre
Som navnet antyder, bruges de til madlavning af kalkuner. Termometret har en luftfyldt beholder lukket med et låg og er kalibreret på en sådan måde, at når den optimale tilberedningstemperatur er nået, hæves låget og udsender en lyd..
Termometeret placeres inde i kalkunen, og når temperaturen inde i ovnen stiger, udvides luften inde i termometeret og øger dets volumen. Løft derefter termometerets låg, når luftens volumen når en bestemt værdi.
Gendannelse af form af bordtennisbolde
Afhængigt af kravene til deres anvendelse er ping-pong-kuglerne lette i vægt, og deres plastvægge er tynde. Dette medfører, at når de er ramt af ketsjere, får de deformationer.
Ved at placere de deformerede kugler i varmt vand, opvarmes luften inde og udvides, hvilket fører til en stigning i luftmængden. Dette får også ping-pong-kuglens væg til at strække sig, så de kan vende tilbage til deres oprindelige form..
Brødfremstilling
Gær inkorporeres i hvedemel, der bruges til at fremstille brød og har evnen til at producere kuldioxidgas..
Når temperaturen på brødene stiger under tilberedningen, øges mængden af kuldioxid. Det er på grund af dette, at brødet udvides, indtil det når det ønskede volumen..
Referencer
- Clark J. (2013). Andre gaslove - Boyles lov og Charles 'lov. Gendannet fra: chemguide.co.uk
- Staroscik Andrew. (2018). Charles 'lov. Gendannet fra: scienceprimer.com
- Wikipedia. (2019). Charles Law. Gendannet fra: en.wikipedia.org
- Helmenstine, Todd. (27. december 2018). Hvad er formlen for Charles 'lov? Gendannet fra: thoughtco.com
- Prof. N. De Leon. (s.f.). Elementær gaslov: Charles Law. C 101 Klasse noter. Gendannet fra: iun.edu
- Briceño Gabriela. (2018). Charles Law. Gendannet fra: euston96.com
- Morris, J. G. (1974). Fysisk-kemi for biologer. (togiver udgave). Redaktionel Reverté, S.A.


Endnu ingen kommentarer