
Atomisk massedefinition, typer, hvordan man beregner den, eksempler

Det atommasse er den mængde stof, der er til stede i et atom, som kan udtrykkes i almindelige fysiske enheder eller i atommasseenheder (uma eller u). Et atom er tomt i det meste af dets struktur; elektroner, der er diffunderet i regioner kaldet orbitaler, hvor der er en vis sandsynlighed for at finde dem, og deres kerne.
Protoner og neutroner findes i atomens kerne; den førstnævnte med positive ladninger, mens den sidstnævnte med neutrale ladninger. Disse to subatomære partikler har en masse, der er meget større end elektronens; Derfor styres et atoms masse af dets kerne og ikke af vakuumet eller elektronerne.
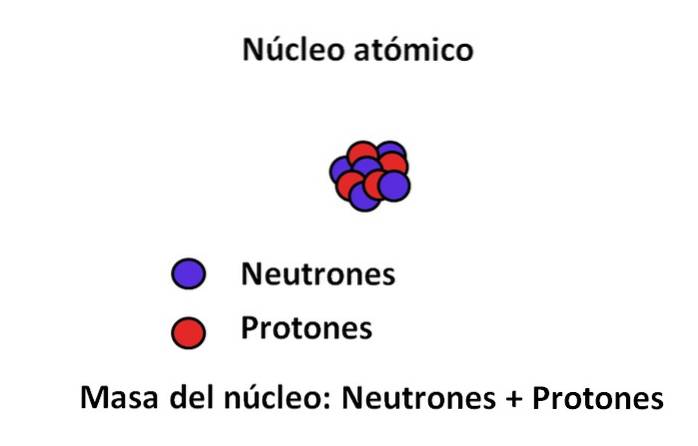
Massen af en elektron er cirka 9.110-31 kg, mens den for protonen 1,67 · 10-27 kg, hvor masseforholdet er 1.800; det vil sige, en proton "vejer" 1.800 gange mere end en elektron. Tilsvarende sker det samme med masserne af neutronen og elektronen. Derfor betragtes elektronbidraget til almindelige formål som ubetydeligt..
På grund af dette antages det ofte, at atomets masse, eller atommassen, kun afhænger af kernens masse; som til gengæld består af summen af neutroner og protoner. To begreber fremgår af denne ræsonnement: massetal og atommasse, begge tæt beslægtede..
Der er så meget "vakuum" i atomerne, og da deres masse næsten udelukkende er en funktion af kernen, kan det forventes, at sidstnævnte er usædvanligt tæt..
Hvis vi fjerner dette tomrum fra ethvert legeme eller objekt, vil dets dimensioner trække sig drastisk sammen. Hvis vi også kunne bygge et lille objekt baseret på atomkerner (uden elektroner), ville det have en masse på millioner af tons..
På den anden side hjælper atommasser med at skelne forskellige atomer af det samme element; disse er isotoperne. Da der er mere isotoper end andre, skal et gennemsnit af atomernes masser estimeres for et givet element; gennemsnit, der kan variere fra planet til planet eller fra et geografisk område til et andet.
Artikelindeks
- 1 Definition og koncept
- 1.1 Atommasseenhed
- 1.2 Ækvivalens i gram
- 2 Gennemsnitlig atommasse
- 2.1 Eksempel
- 3 Absolut atommasse
- 4 Relativ atommasse
- 5 Sådan beregnes atommassen
- 6 eksempler
- 6.1 Kulstof
- 6.2 Natrium
- 6.3 Oxygen
- 6.4 Kvælstof
- 6.5 Klor
- 6.6 Dysprosium
- 7 Referencer
Definition og koncept
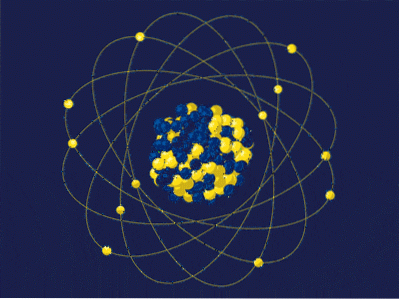
Per definition er atommassen summen af masserne af dens protoner og neutroner udtrykt med uma eller u. Det resulterende tal (også undertiden kaldet massenummer) placeres dimensionsløst i øverste venstre hjørne i notationen anvendt til nuklider. For eksempel for elementet femtenX dens atommasse er 15uma eller 15u.
Atommassen kan ikke fortælle meget om den rigtige identitet af dette element X. I stedet bruges atomnummeret, hvilket svarer til protonerne i kernen af X. Hvis dette tal er 7, vil forskellen (15-7) være lig med 8; X har 7 protoner og 8 neutroner, hvis sum er 15.
Når vi vender tilbage til billedet, har kernen 5 neutroner og 4 protoner, så dens massetal er 9; og til gengæld er 9 amu dets masse. Ved at have 4 protoner og konsultere det periodiske system kan det ses, at denne kerne svarer til elementet beryllium, Be (eller 9Være).
Atommasseenhed
Atomer er for små til at kunne måle deres masser ved hjælp af konventionelle metoder eller almindelige vægte. Det er af denne grund, at uma, u eller Da (farveblind) blev opfundet. Disse enheder, der er udviklet til atomer, giver dig mulighed for at få en idé om, hvor massivt et elements atomer er i forhold til hinanden..
Men hvad repræsenterer en amu nøjagtigt? Der skal være en reference, der gør det muligt at etablere masseforhold. Til dette blev atomet brugt som reference 12C, som er den mest rigelige og stabile isotop for kulstof. At have 6 protoner (dets atomnummer Z) og 6 neutroner, dets atommasse er derfor 12.
Antagelsen antages, at protoner og neutroner har de samme masser, så hver bidrager med 1 amu. Atommasseenheden defineres derefter som en tolvtedel (1/12) af massen af et carbon-12-atom; dette er massen af en proton eller neutron.
Ækvivalens i gram
Og nu opstår følgende spørgsmål: hvor mange gram svarer 1 amu til? Da der først ikke var tilstrækkelig avancerede teknikker til at måle det, måtte kemikere nøjes med at udtrykke alle masser med amu; dette var dog en fordel og ikke en ulempe.
Hvorfor? Fordi subatomære partikler er så små, må deres masse udtrykt i gram have været lige så lille. Faktisk er 1 amu lig med 1.6605 · 10-24 gram. Derudover var det ikke et problem at bruge masserne af elementerne og deres isotoper med amu ved at vide, at sådanne enheder kunne modificeres til g / mol.
For eksempel at gå tilbage til femtenX og 9Vær, vi har, at deres atommasser er henholdsvis 15 amu og 9 amu. Da disse enheder er så små og ikke direkte fortæller, hvor meget stof man skal "veje" for at manipulere dem, omdannes de til deres respektive molmasser: 15 g / mol og 9 g / mol (introduktion til begreberne mol og Avogadros antal ).
Gennemsnitlig atommasse
Ikke alle atomer af det samme element har den samme masse. Dette betyder, at de skal have flere subatomære partikler i kernen. At være det samme element, skal atomnummeret eller antallet af protoner forblive konstant; derfor er der kun variation i mængderne af neutroner, der besidder.
Dette fremgår af definitionen af isotoper: atomer af det samme element, men med forskellige atommasser. For eksempel består beryllium næsten udelukkende af isotopen 9Vær med spor af 10Være. Imidlertid er dette eksempel ikke særlig nyttigt til forståelse af begrebet gennemsnitlig atommasse; vi har brug for en med flere isotoper.
Eksempel
Antag at elementet findes 88J, dette er J's vigtigste isotop med en overflod på 60%. J har også to andre isotoper: 86J, med en overflod på 20%, og 90J, med en overflod også på 20%. Dette betyder, at ud af 100 J-atomer, som vi samler på jorden, er 60 af dem 88J, og de resterende 40 en blanding af 86J og 90J.
Hver af de tre isotoper af J har sin egen atommasse; det vil sige deres sum af neutroner og protoner. Imidlertid skal disse masser beregnes i gennemsnit for at have en atommasse for J ved hånden; her på Jorden, da der kan være andre regioner i universet, hvor overflod af 86J er 56% og ikke 60%.
For at beregne den gennemsnitlige atommasse af J skal det vejede gennemsnit af masserne af dens isotoper opnås; det vil sige under hensyntagen til procentdelen af overflod for hver af dem. Således har vi:
Gennemsnitlig masse (J) = (86 amu) (0,60) + (88 amu) (0,20) + (90 amu) (0,20)
= 87,2 amu
Det vil sige, den gennemsnitlige atommasse (også kendt som atomvægten) af J er 87,2 amu. I mellemtiden er dens molære masse 87,2 g / mol. Bemærk, at 87.2 er tættere på 88 end til 86, og den er også fjern fra 90.
Absolut atommasse
Den absolutte atommasse er atommassen udtrykt i gram. Med udgangspunkt i eksemplet med det hypotetiske element J kan vi beregne dets absolutte atommasse (gennemsnittet) ved at vide, at hver amu svarer til 1.6605 · 10-24 gram:
Absolut atommasse (J) = 87,2 amu * (1,6605 · 10-24 g / am)
= 1.447956 10-22 g / atom J
Dette betyder, at J-atomer i gennemsnit har en absolut masse på 1,447956 · 10-22 g.
Relativ atommasse
Den relative atommasse er numerisk identisk med den gennemsnitlige atommasse for et givet element; Men i modsætning til det andet mangler den første enhed. Derfor er det dimensionsløst. For eksempel er den gennemsnitlige atommasse af beryllium 9,012182 u; mens dens relative atommasse simpelthen er 9.012182.
Derfor fortolkes disse begreber undertiden fejlagtigt som synonymer, da de er meget ens, og forskellene mellem dem er subtile. Men hvad er disse masser i forhold til? I forhold til en tolvtedel af massen af 12C.
Således betyder et element med en relativ atommasse på 77, at det har en masse 77 gange større end 1/12 af 12C.
De, der har set på elementerne i det periodiske system, vil se, at deres masser er relativt udtrykt. De har ikke enheder af amu, og det fortolkes som: jern har en atommasse på 55.846, hvilket betyder, at det er 55.846 gange mere masse end massen på 1/12 af 12C, og som også kan udtrykkes som 55,846 amu eller 55,846 g / mol.
Sådan beregnes atommassen
Matematisk blev der givet et eksempel på, hvordan man beregner det med eksemplet med element J. Generelt skal den vægtede gennemsnitlige formel anvendes, hvilket vil være:
P = Σ (isotop atommasse) (overflod i decimaler)
Med andre ord, at have atommasserne (neutroner + protoner) af hver isotop (normalt naturligt) for et givet element såvel som deres respektive jordbundsmængder (eller hvad som helst regionen betragtes), kan det vægtede gennemsnit beregnes..
Og hvorfor ikke bare det aritmetiske gennemsnit? For eksempel er den gennemsnitlige atommasse af J 87,2 amu. Hvis vi beregner denne masse igen, men aritmetisk, har vi:
Gennemsnitlig masse (J) = (88 amu + 86 amu + 90 amu) / 3
= 88 amu
Bemærk, at der er en vigtig forskel mellem 88 og 87.2. Dette skyldes, at det aritmetiske gennemsnit antager, at overfladen af alle isotoper er den samme; Da der er tre isotoper af J, bør hver have en overflod på 100/3 (33,33%). Men dette er ikke tilfældet i virkeligheden: der er meget mere rigelige isotoper end andre.
Derfor beregnes det vægtede gennemsnit, da det ikke tager højde for, hvor rig en isotop er i forhold til en anden..
Eksempler
Kulstof
For at beregne den gennemsnitlige atommasse af kulstof har vi brug for dens naturlige isotoper med deres respektive overflod. I tilfælde af kulstof er disse: 12C (98,89%) og 13C (1,11%). Deres relative atommasser er henholdsvis 12 og 13, som igen er lig med 12 amu og 13 amu. Løsning:
Gennemsnitlig atommasse (C) = (12 amu) (0,9889) + (13 amu) (0,0111)
= 12,0111 amu
Derfor er massen af et carbonatom i gennemsnit 12,01 amu. Da der er spor af 14C, har næsten ingen indflydelse på dette gennemsnit.
Natrium
Alle terrestriske natriumatomer består af isotopen 2. 3Na, så dens overflod er 100%. Derfor kan massen i almindelige beregninger antages at være simpelthen 23 amu eller 23 g / mol. Den nøjagtige masse er dog 22,98976928 amu.
Ilt
De tre isotoper af ilt med deres respektive overflader er: 16O (99,762%), 17O (0,038%) og 18O (0,2%). Vi har alt for at beregne dens gennemsnitlige atommasse:
Gennemsnitlig atommasse (O) = (16 amu) (0,99762) + (17 amu) (0,00038) + (18 amu) (0,002)
= 16,00438 amu
Selvom den rapporterede nøjagtige masse faktisk er 15.9994 amu.
Kvælstof
Gentagelse af de samme trin med ilt, som vi har: 14N (99,634%) og femtenN (0,366%). Derefter:
Gennemsnitlig atommasse (N) = (14 amu) (0,99634) + (15 amu) (0,00366)
= 14,00366 amu
Bemærk, at den rapporterede masse for kvælstof er 14.0067 amu, lidt højere end den, vi har beregnet.
Klor
Klorisotoperne med deres respektive overflader er: 35Cl (75,77%) og 37Cl (24,23%). Beregning af den gennemsnitlige atommasse, vi har:
Gennemsnitlig atommasse (Cl) = (35 amu) (0,7577) + (37 amu) (0,2423)
= 35,4846 amu
Meget svarende til det rapporterede (35.453 amu).
Dysprosium
Og endelig beregnes den gennemsnitlige masse af et element med mange naturlige isotoper: dysprosium. Disse og med deres respektive overflod er: 156Dy (0,06%), 158Dy (0,10%), 160Dy (2,34%), 161Dy (18,91%), 162Dy (25,51%), 163Dy (24,90%) og 164Dy (28,18%).
Vi fortsætter som i de foregående eksempler med at beregne atommassen for dette metal:
Gennemsnitlig atommasse (Dy) = (156 amu) (0.0006%) + (158 amu) (0.0010) + (160 amu) (0.0234) + (161 amu) (0.1891) + (162 amu) (0.2551) + (163 amu) (0.2490) + (164 amu) (0.2818)
= 162,5691 amu
Den rapporterede masse er 162.500 amu. Bemærk, at dette gennemsnit er mellem 162 og 163, da isotoperne 156D y, 158Dy og 160Dy er få rigelige; mens de, der dominerer, er 162D y, 163Dy og 164D y.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2019). Atommasse. Gendannet fra: en.wikipedia.org
- Christopher Masi. (s.f.). Atomic Mass. Gendannet fra: wsc.mass.edu
- Natalie Wolchover. (12. september 2017). Hvordan vejer du et atom? WordsSideKick.com. Gendannet fra: livescience.com
- Kemi LibreTexts. (5. juni 2019). Beregning af atommasser. Gendannet fra: chem.libretexts.orgs
- Edward Wichers og H. Steffen Peiser. (15. december 2017). Atomvægt. Encyclopædia Britannica. Gendannet fra: britannica.com



Endnu ingen kommentarer