
Molaritetskoncentration, enheder, beregning, øvelser
Det molaritet er koncentrationen af en opløsning udtrykt i mol opløst stof pr. liter opløsning. Det forkortes som M og udtrykker et forhold mellem massen af det opløste stof og opløsningens volumen (m / v); skønt dette forhold traditionelt udtrykkes som vægt til volumen.
En mol er antallet af atomer eller molekyler indeholdt i atom- eller molekylvægten; Det udtrykkes i gram / mol. En mol svarer til 6,02 · 102. 3 atomer eller molekyler, kendt som Avogadros nummer.
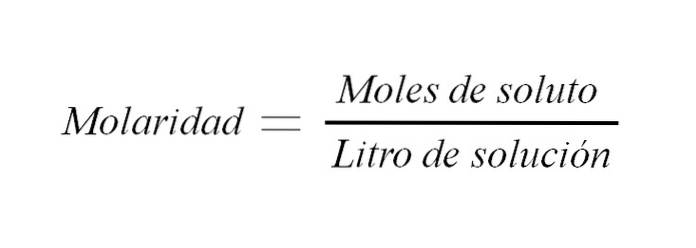
Der er andre måder at udtrykke forholdet mellem massen af et opløst stof og volumenet, herunder: det procentuelle forhold mellem massen af det opløste stof og volumenet af opløsningen og normalitet. Sidstnævnte udtrykkes som antallet af ækvivalenter af et opløst stof pr. Liter opløsning.
I mellemtiden udtrykker molalitet, der er defineret som antallet af mol pr. Kg opløsningsmiddel, normalt vand, et forhold mellem opløsningsmassens masse og opløsningsmidlets masse (m / m)..
Formen for ekspression af koncentrationen af en opløsning i dele pr. Million (ppm) udtrykker et forhold mellem en del af det opløste stof og en million dele af opløsningen, der generelt bruges til at udtrykke et massemasse-forhold (m / m) . Men du kan udtrykke et massevolumen-forhold (m / v).
Den molære koncentration kan ud over at være udtrykt i mol pr. Liter udtrykkes som millimol / liter (millimolær opløsning); mikromol / liter (mikromolær opløsning); etc.
Molaritetsproblemer kan løses ved hjælp af en analysemetode og ved hjælp af "reglen om tre". Valget af en metode afhænger af den færdighed, du har i brugen af en af metoderne.
Artikelindeks
- 1 molær koncentration
- 2 enheder
- 3 Sådan beregnes molaritet?
- 4 Gå fra molaritet til molalitet
- 4.1 Første trin
- 4.2 Andet trin
- 4.3 Tredje trin
- 4.4 Fjerde trin
- 4.5 Femte trin
- 4.6 Numerisk eksempel
- 5 Problemer løst
- 5.1 Opgave 1
- 5.2 Opgave 2
- 5.3 Opgave 3
- 5.4 Opgave 4
- 5.5 Opgave 5
- 6 Referencer
Molær koncentration
Det bruges til at udtrykke koncentrationen af et opløst stof i et givet volumen opløsning.
M = n / V (1)
Hvor M er lig med molaritet, er n antallet af mol, og V er opløsningens volumen. Så molariteten af en opløsning er antallet af mol opløst stof pr. Volumen opløsning udtrykt i liter.
På den anden side er antallet af mol
n = m / PM (2)
Hvor m er massen af det opløste opløste stof og PM dets molære masse.
Erstatning (2) i (1):
M = (m / PM) / V.
Enheder
Enheden i det internationale system for molær koncentration er mol / m3. Dette svarer til en millimolær opløsning, fordi am3 svarer til 1.000 liter. I grenene af kemi og biologi udtrykkes molær koncentration normalt som mol / L. Denne enhed udtrykkes med M (store bogstaver).
En opløsning af en mol / L svarer til en opløsning M; en opløsning på 10-3 mol / L, lig med 1 mM (millimolar); og en opløsning på 10-6 mol / L, svarer til 1 µM (mikromolar).
Sådan beregnes molaritet?
Det er praktisk at bruge de ovenfor angivne udtryk, fordi dette sikrer, at resultatet af anvendelse af formlen giver i mol / liter, hvilket er definitionen af molær koncentration.
For at beregne molariteten af en opløsning er det derefter nødvendigt at udtrykke koncentrationen af det opløste stof i g / L. Find derefter molekylvægten af det opløste stof (g / mol) og find forholdet mellem koncentrationen og molekylvægten. Det opnåede resultat er molariteten udtrykt i mol / liter.
Gå fra molaritet til molalitet
Et nødvendigt stykke information for at gå fra molaritet til molalitet er at kende opløsningens tæthed. Dette gør det muligt at kende opløsningens masse, et vigtigt krav til beregning af molalitet..
Første skridt
Først skal du gå fra molkoncentrationen til gram / liter. For at gøre dette er det tilstrækkeligt at multiplicere opløsningens molaritet med opløsningsmidlets molekylvægt..
Gram / liter opløst stof = molaritet (mol / liter) · Molekylvægt af opløst stof (gram / mol).
Dette gør det muligt at opnå massen af det opløste stof i 1 liter opløsning.
Andet trin
Derefter er det nødvendigt at beregne massen af opløsningen. Til dette anvendes densiteten af det. Normalt udtrykkes densiteten i gram / kubikcentimeter eller milliliter.
Masse af opløsning (g) = volumen af opløsning (ml) densitet (g / ml)
Tredje trin
Opnåelse af opløsningsmidlets masse. Da massen af opløsningen er lig med massen af det opløste stof plus massen af opløsningsmidlet, for at opnå massen af sidstnævnte er det nok at trække massen af det opløste stof (trin 1) fra massen af opløsningen ( trin 2)..
Fjerde trin
Endelig skal opløsningens opløste masse (g) overføres til den opløste masse, der svarer til 1.000 g eller 1 kg opløsningsmiddel. For at gøre dette ville det være nok at udføre en simpel regel med tre eller en anden tilsvarende matematisk operation.
Femte trin
Del g opløst stof / 1000 g opløsningsmiddel med molekylvægten af det opløste stof (g / mol) for at opnå molaliteten af opløsningen.
Numerisk eksempel
En 3 M glucoseopløsning (molekylvægt 180 g / mol) har en densitet på 1,15 g / ml. Beregn molaliteten af denne opløsning.
Vi beregner først gram glucose opløst i en liter opløsning:
g / L = 3 mol / L 180 g / mol
= 540 g / l
Derefter beregner vi massen af opløsningen ud fra dens densitet:
g opløsning (masse) = 1.000 ml 1,15 g / ml
= 1.150 g
Massen af opløsningsmiddel er givet ved forskellen:
Masse af opløsningsmiddel = masse af opløsning - masse af opløst stof
= 1.150 g - 540 g
= 610 g
Men 610 g er ikke 1000 g opløsningsmiddel som defineret i definitionen af molalitet. Derfor skal det beregnes, hvor mange gram glukose der er opløst i 1000 g opløsningsmiddel:
Massen af opløst stof = 540 g opløst stof (1.000 g opløsningsmiddel / 610 g opløsningsmiddel)
= 885,25 g
Og endelig beregnes molaliteten ved at returnere gram til mol:
Molalitet = (885,25 g opløst stof / 180 g / mol)
= 4,92 mol opløst stof / kg opløsningsmiddel
= 4,92 m
Problemer løst
Opgave 1
Hvor meget kobbersulfat vil det tage at forberede 500 ml af en 0,4 M opløsning? Udtryk resultatet i gram. Molekylvægt af kobbersulfat (CuSO4160 g / mol.
Vi bestemmer først de mol, der skal opløses i en sådan opløsning:
M = n / V
n = M V
n = (0,4 mol / l) 0,5 l
= 0,2 mol
Når man kender antallet af mol kobbersulfat, kan dets masse opnås
n = m / PM
m = nmolekylær vægt
m = 0,2 mol 160 g / mol
= 32 g CuSO4
Det vil sige, 32 gram af dette salt skal opløses i 500 ml opløsningsmiddel.
Opgave 2
Hvilket volumen af en opløsning er nødvendig, så når 0,4 mol opløst stof opløses, har det en koncentration på 0,25 M?
Opløsningens volumen opnås ud fra begrebet molaritet
M = n / V
V = n / M
V = 0,4 mol / (0,25 mol / L)
= 1,6 l
Det betyder, at opløsningen skal have et volumen på 1,6 liter for at opnå en sådan koncentration på 0,25 M.
Opgave 3
En masse på 8 g natriumhydroxid (NaOH) opløses i 60 g af en opløsning, der har en densitet på 1,6 g / ml. Hvad vil løsningen være molaritet? Natriumhydroxidmolekylvægt: 40 g / mol.
Mol NaOH skal først beregnes:
n = m / PM
= 8 g natriumhydroxid / (40 g / mol)
= 0,2 mol
Nu fortsætter vi med at beregne volumen af løsningen:
m = V d
v = 60 g / (1,6 g / ml)
v = 37,5 ml
For at opnå molariteten skal opløsningsvolumenet i liter placeres:
V = 37,5 ml10-3 L / ml
= 0,0375 L.
M = 0,2 mol / 0,0375 l
5,33 mol / l
5,33 M
Opgave 4
Beregn molariteten af en saltsyreopløsning (HCI) med en densitet på 1,25 g / ml og en koncentration på 35%, udtrykt masse / masse. Saltsyremolekylvægt: 36,5 g / mol.
Bestem massen af 35% saltsyre
m = V d
m = 1.000 ml 1,25 g / ml
= 1.250 g
Men ikke alt er HCI, der er også vand:
masse HCI = 1.250 g (35/100)
= 437,5 g
Hvilket er det samme som at sige, at der i en liter 35% HCI-opløsning er 437,5 gram HCI.
Derefter beregnes mol HCI for straks at bestemme molariteten:
n = m / PM
n = (437,5 g / L) / (36,5 g / mol)
= 11,98 mol / l
Molaritet = 11,98 M
Opgave 5
Beregn molariteten af en opløsning indeholdende 5 g NaCl i 2 liter opløsning. Molekylvægt af natriumchlorid: 58,5 g / mol.
Mol / l NaCl kan opnås i et enkelt trin:
molaritet = (5 g NaCl / 2 L opløsning) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol / l
Molaritet = 0,043 M
En anden procedure kan være:
g / L NaCl = 5 g / 2 L
= 2,5 g / l
mol / L = (2,5 g / L) / (58,5 g / mol)
= 0,043 mol / l
= 0,043 M
Referencer
- Rodríguez, M. (2007). Kemi. Salesian Editorial Foundation
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2019). Molaritet Gendannet fra: es.wikipedia.org
- Atarés Huerta. (s.f.). Molaritet og molalitet. [PDF]. Gendannet fra: riunet.upv.es
- Softchools. (2019). Molaritetsformel. Gendannet fra: softschools.com


Endnu ingen kommentarer