
Magnesiumnitrat (Mg (NO3) 2) struktur, egenskaber, anvendelser

Det magnesiumnitrat er et uorganisk fast stof, hvis kemiske formel er Mg (NO3)to. Det er en ionisk forbindelse dannet ved foreningen af et magnesiumkation Mgto+ og to nitratanioner NO3-.
Mg (NEJ3)to det er et hvidt krystallinsk fast stof. Det er meget hygroskopisk, det vil sige, det absorberer let vand fra miljøet. Når den forbliver i kontakt med den omgivende luft, har den tendens til at danne sit Mg hexahydrat (NO3)to•6HtoELLER.

Magnesiumnitrat Hexahydrat Mg (NO3)to•6HtoO har i sin krystallinske struktur 6 molekyler vand HtoEller for hvert molekyle af Mg (NO3)to. Magnesiumnitrat findes i huler og miner i form af mineralet nitromagnesit.
Mg (NEJ3)to opnået kommercielt ved omsætning af magnesiummetal Mg med salpetersyre HNO3.
Det har en lang række anvendelser, for eksempel i landbruget som gødning, fordi det giver næringsstoffer til planter såsom nitrogen (N) og magnesium (Mg)..
Det bruges i fyrværkeri eller pyroteknisk industri og også til opnåelse af koncentreret salpetersyre. Anvendes i kemisk analyse, fysikeksperimenter og medicinske og videnskabelige studier.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Opløselighed
- 3.7 Effekt af opvarmning
- 4 Opnåelse
- 4.1 Placering i naturen
- 5 anvendelser
- 5.1 I nyere undersøgelser
- 5.2 I sygdomsundersøgelser
- 6 Referencer
Struktur
Vandfrit magnesiumnitrat består af en magnesiumkation Mgto+ og to nitratanioner NO3-.
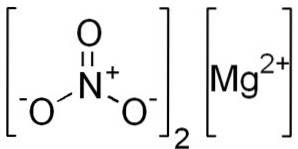
Magnesiumion Mgto+ har elektronkonfiguration: 1sto, 2sto 2 s6, 3s0, da det har givet de to elektroner i den yderste skal (3s). Denne konformation er meget stabil.
NO-ionen3- har en flad og symmetrisk struktur.
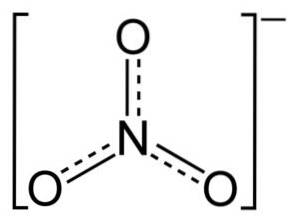
I strukturen af NO3- den negative ladning fordeles kontinuerligt mellem de tre iltatomer.
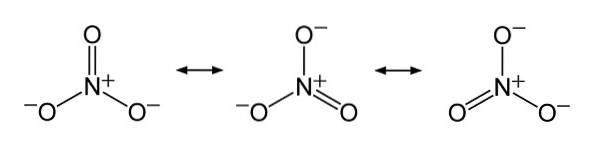
Nomenklatur
-Vandfrit magnesiumnitrat: Mg (NO3)to
-Magnesiumnitratdihydrat: Mg (NO3)to•2HtoELLER
-Magnesiumnitrathexahydrat: Mg (NO3)to•6HtoELLER
-Magnesium dinitrat
Ejendomme
Fysisk tilstand
-Mg (NEJ3)to vandfri: hvide faste, kubiske krystaller.
-Mg (NEJ3)to dihydrat: hvidt krystallinsk fast stof.
-Mg (NEJ3)to hexahydrat: farveløse faste, monokliniske krystaller
Molekylær vægt
-Mg (NEJ3)to vandfri: 148,31 g / mol
-Mg (NEJ3)to hexahydrat: 256,41 g / mol
Smeltepunkt
-Mg (NEJ3)to hexahydrat: 88,9 ºC
Kogepunkt
-Mg (NEJ3)to hexahydrat: koger ikke, nedbrydes ved 330 ºC
Massefylde
-Mg (NEJ3)to vandfri: 2,32 g / cm3
-Mg (NEJ3)to dihydrat: 1,456 g / cm3
-Mg (NEJ3)to hexahydrat: 1.464 g / cm3
Opløselighed
Vandfrit magnesiumnitrat er meget opløseligt i vand: 62,1 g / 100 ml ved 0 ºC; 69,5 g / 100 ml ved 20 ° C Det er også meget hygroskopisk, når det kommer i kontakt med luft, dannes det hurtigt hexahydratet.
Mg (NEJ3)to dihydrat er også meget opløseligt i vand og ethanol. Det er hygroskopisk.
Mg (NEJ3)to hexahydrat er også meget opløseligt i vand. Det er moderat opløseligt i ethanol. Det er den mest stabile af de tre, der er i kontakt med luft, det vil sige af de tre, der absorberer mindst vand fra miljøet.
Opvarmningseffekt
Ved at udsætte en vandig opløsning af Mg (NO3)to Efter inddampning af vand er det salt, der krystalliserer hexahydratet: Mg (NO3)to•6HtoO. Hexahydrat betyder, at i det faste stof hvert molekyle af Mg (NO3)to er bundet til 6 vandmolekyler.
Der er også dihydratet Mg (NO3)to•2HtoEller hvor Mg (NO3)to fast stof er bundet til 2 vandmolekyler.
Opvarmning af Mg hexahydrat (NO3)to•6HtoEller det vandfri salt opnås ikke, da magnesiumnitrat har en høj affinitet for vand.
Af denne grund, når det opvarmes over dets smeltepunkt, danner det oprindeligt et blandet salt af magnesiumnitrat og hydroxid Mg (NO3)to•4 mg (OH)to.
Når dette blandede salt når 400 ° C, nedbrydes det til magnesiumoxid MgO, og nitrogenoxidgasser frigøres..
Opnåelse
Det kan fremstilles ved omsætning af magnesiumcarbonat MgCO3 med salpetersyre HNO3, afgiver kuldioxid COto:
MgCO3 + 2 HNO3 → Mg (NO3)to + COto↑ + HtoELLER
Det kan også opnås med magnesiumhydroxid Mg (OH)to og salpetersyre:
Mg (OH)to + 2 HNO3 → Mg (NO3)to + 2 timertoELLER
Kommercielt opnås det på flere måder:
1- Omsætning af magnesiummetallet Mg med salpetersyre HNO3.
2- Ved at reagere magnesiumoxid MgO med salpetersyre HNO3.
3- Bindende magnesiumhydroxid Mg (OH)to og ammoniumnitrat NH4IKKE3, danner magnesiumnitrat med udviklingen af ammoniak NH3.
Placering i naturen
Mg (NEJ3)to hexahydrat forekommer naturligt i miner og huler eller huler i form af mineralet nitromagnesit.
Dette mineral er til stede, når guano kommer i kontakt med magnesiumrige sten. Guano er materialet som følge af ekskrementer af havfugle og sæler i meget tørre omgivelser..
Ansøgninger
Mg (NEJ3)to hexahydrat anvendes i den keramiske, kemiske og landbrugsindustri.
Denne forbindelse er en gødning, fordi den tilfører nitrogen (N), som er et af de tre grundlæggende elementer, der kræves af planterne, og magnesium (Mg), som er en sekundær komponent, der også er vigtig for planter..
På denne måde bruges det sammen med andre ingredienser i drivhuse og i hydroponisk dyrkning. Sidstnævnte består i at dyrke planterne i en vandig opløsning med gødningssalte i stedet for jord.

Det bruges også som en katalysator til opnåelse af petrokemiske forbindelser. Det gør det muligt at justere viskositeten i visse processer. Vandfrit magnesiumnitrat anvendes i pyroteknik, det vil sige til fremstilling af fyrværkeri.

Vandfrit magnesiumnitrat er et dehydratiseringsmiddel. Det bruges for eksempel til at opnå koncentreret salpetersyre, da det eliminerer vand og koncentrerer syredampe op til 90-95% HNO3.

Det bruges også til at belægge ammoniumnitrat og tillade dannelse af perler af dette komprimerede materiale..
Det er nyttigt i formuleringen af blæk, toner (sort pulver, der anvendes i fotokopieringssystemer) og farveprodukter. Fungerer som en magnesiumstandard inden for analytisk kemi.
Saltet af magnesiumnitrat og cerium Mg (NO3)to•Rynke panden3)3 Det er af interesse i fysikeksperimenter ved lave temperaturer, da det bruges som kølemiddel i adiabatiske demagnetiseringseksperimenter (uden varmeoverførsel).
Dette magnesium- og ceriumsalt er blevet brugt til at etablere ekstremt lave temperaturniveauer på Kelvin-skalaen (tæt på absolut nul)..
I nylige undersøgelser
Flere forskere har brugt Mg (NO3)to i sammensætninger med syntetiske og naturlige polymerer for at øge ledningsevnen i magnesiumionbatterier.
Det er også blevet undersøgt i konstruktionen af superkondensatorer til opbevaring af energi med høj effekt.
I sygdomsundersøgelser
Magnesiumnitrat er blevet administreret til laboratorierotter med arteriel hypertension (højt tryk) og blev fundet at effektivt sænke blodtrykket og dæmpe eller blødgøre virkningerne af komplikationer af denne sygdom.
Det har også vist beskyttende virkninger mod neurologiske lidelser (neuronal lidelse) og mod død hos rotter under tilslutningsprocesser i halspulsåren..
Referencer
- Qian, M. et al. (2018). Ekstraordinære porøse få-lags kulhydrater med høj kapacitet fra Pechini-forbrænding af magnesiumnitratgel. ACS Appl Mater-grænseflader 2018, 10 (1): 381-388. Gendannet fra ncbi.nlm.nih.gov.
- Manjuladevi, R. et al. (2018). En undersøgelse af blandet polymerelektrolyt baseret på poly (vynilalkohol) -poly (acrylonitril) med magnesiumnitrat til magnesiumbatteri. Ionics (2018) 24: 3493. Gendannet fra link.springer.com.
- Kiruthika, S. et al. (2019). Miljøvenlig biopolymerelektrolyt, pektin med magnesiumnitratsalt, til anvendelse i elektrokemiske enheder. J Solid State Electrochem (2019) 23: 2181. Gendannet fra link.springer.com.
- Vilskerts R. et al. (2014). Magnesiumnitrat dæmper blodtryksstigningen i SHR-rotter. Magnes Res 2014, 27 (1): 16-24. Gendannet fra ncbi.nlm.nih.gov.
- Kuzenkov V.S. og Krushinskii A.L. (2014). Beskyttende virkning af magnesiumnitrat mod neurologiske lidelser fremkaldt af cerebral iskæmi hos rotter. Bull Exp Biol Med 2014, 157 (6): 721-3. Gendannet fra ncbi.nlm.nih.gov.
- Ropp, R.C. (2013). Gruppe 15 (N, P, As, Sb og Bi) alkaliske jordforbindelser. Magnesiumnitrat. I Encyclopedia of the Alkaline Earth Compounds. Gendannet fra sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Bind 1. fjerde udgave. John Wiley & Sons.
- OS. National Library of Medicine. (2019). Magnesiumnitrat. Gendannet fra: pubchem.ncbi.nlm.nih.gov.



Endnu ingen kommentarer