
Natriumnitrit (NaNO2) struktur, egenskaber, anvendelser, risici

Det natriumnitrit er et krystallinsk uorganisk fast stof dannet af en natriumion Na+ og en nitrition NOto-. Dens kemiske formel er NaNOto. Det er et hvidt krystallinsk fast stof, der har tendens til at absorbere vand fra miljøet, det vil sige det er hygroskopisk.
I nærvær af luft oxideres den langsomt til natriumnitrat NaNO3. Det har oxiderende egenskaber (det oxiderer andre forbindelser) og reducerer også egenskaber (det oxideres af andre forbindelser).

Det findes naturligt i den menneskelige krop og bruges som konserveringsmiddel til saltet kød og røget fisk, da det forhindrer væksten af skadelige mikroorganismer..
Det har en vigtig anvendelse i nødbehandling af cyanidforgiftning, da det reducerer den toksiske og dødelige virkning af denne forbindelse. Det skal dog administreres med stor forsigtighed og fungerer ikke i alle tilfælde.
Det har vist sig, at det kunne forhindre øjeninfektioner forårsaget af forurening af kontaktlinser af mikroorganismer. Nogle undersøgelser viser, at dets forbrug med mad kan forårsage kræft, men det anslås, at dette kan undgås ved at indtage C-vitamin sammen med sådanne fødevarer..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Opløselighed
- 3,7 pH
- 3.8 Andre egenskaber
- 4 Opnåelse
- 4.1 Tilstedeværelse i kroppen
- 5 anvendelser
- 5.1 I fødevareindustrien
- 5.2 Som nødbehandling i cyanidforgiftning
- 5.3 Til udvidelse af blodkar
- 5.4 Mod nogle parasitter
- 5.5 For at undgå organskader
- 5.6 For at undgå infektioner på grund af brugen af kontaktlinser
- 5.7 I forskellige anvendelser
- 6 Risici eller ulemper
- 7 Referencer
Struktur
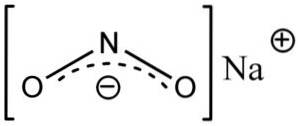
Natriumnitrit består af natriumkationen Na+ og nitritanionen NOto-.
I nitritanionen NOto- kvælstof har en valens på +3 og ilt på -2, af denne grund har anionen en enkelt global negativ ladning.
Nitritanion NOto- har en vinkelstruktur, dvs. nitrogenbindinger (N) med iltatomer (O) danner en vinkel.
Nomenklatur
- Natriumnitrit
- Natriumnitrit
- Salpetersyrenatriumsalt.
Ejendomme
Fysisk tilstand
Gulhvidt krystallinsk fast stof. Orthorhombiske krystaller.
Molekylær vægt
68,995 g / mol
Smeltepunkt
271 ºC
Kogepunkt
Det koger ikke. Det nedbrydes over 320 ºC
Massefylde
2,17 g / cm3 ved 20 ºC
Opløselighed
Opløselig i vand: 84,8 g / 100 g vand ved 25 ºC. Let opløselig i ethanol. Moderat opløselig i methanol. Sparsomt opløselig i diethylether.
pH
Dens vandige opløsninger er basiske, med en pH på ca. 9. Dette skyldes, at salpetersyre er en svag syre, der har tendens til ikke at adskille sig, så NO-ionento- prøv at tage en proton H+ vand til dannelse af HNOto, hvilket fører til dannelsen af OH-ioner- der producerer alkalinitet.
IKKEto- + HtoO → HNOto + Åh-
Andre egenskaber
Natriumnitrit NaNOto i nærvær af luft oxideres langsomt til natriumnitrat NaNO3. Det er et hygroskopisk fast stof, da det absorberer vand fra miljøet.
Det har oxiderende egenskaber (det kan oxidere andre forbindelser) og også reducerende egenskaber (det kan oxideres af andre forbindelser).
Hvis det kommer i kontakt med materialer som træ, papir eller tekstiler, kan det få dem til at antændes farligt..
Med syrer finder dets nedbrydning sted, hvorved der dannes en blanding af brune giftige gasser af nitrogenoxider (NOx).
Opnåelse
Det kan opnås ved opvarmning af natriumnitrat NaNO3 med bly Pb:
Storebror3 + Pb → NaNOto + PbO
Tilstedeværelse i kroppen
Nitritanion er naturligt til stede i blod og væv, da den dannes som et resultat af NO-oxidation..
Ansøgninger
I fødevareindustrien
Det bruges til at marinere kød, da det fungerer som et farve- og smagsretentionsmiddel og som et konserveringsmiddel, da det styrer væksten af mikroorganismer og især undgår udvikling af Clostridium botulinum forårsager botulisme sygdom.
Natriumnitrit i kød reagerer med hæmoglobin i røde blodlegemer eller røde blodlegemer i denne mad. Anvendes også i hærdet røget fisk.

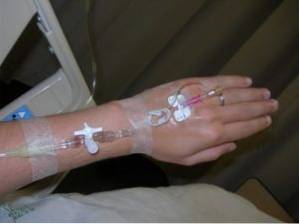
Som en nødbehandling for cyanidforgiftning
Natriumnitrit bruges til behandling af akut cyanidforgiftning. Det er en modgift mod dette alvorlige problem.
Dens virkning skyldes det faktum, at det favoriserer dannelsen af methemoglobin (en type hæmoglobin) i blodet, som fælder cyanidioner og ikke frigiver dem og dermed forhindrer dem i at blive frigivet i celler, hvilket gør dem mindre giftige.
I tilfælde af cyanidforgiftning påføres natriumnitrit intravenøst, hvilket tager cirka 12 minutter at generere methemoglobin. På trods af denne forsinkelse tilbyder den også beskyttelse på grund af dens vasodilaterende effekt..
Til udvidelse af blodkar
Det bruges til at behandle pulmonal arteriel hypertension, da det virker ved at udvide blodkar og dermed sænke blodtrykket. Det anslås, at denne effekt skyldes, at den omdannes til nitrogenoxid NO, som virker ved at slappe af de bløde muskler..
Årsagerne til dens effektivitet er dog stadig under undersøgelse..
Mod nogle parasitter
Visse forskere fandt ud af, at natriumnitrit hæmmer væksten og formeringen af tarmparasitten Blastocystis hominis selvom det er resistent over for anden medicin.
NaNO blev fundetto genererer denne parasits død ved apoptose, som er en slags selvmord på parasitcellen. Natriumnitrit får tarmceller til at producere NO, hvilket synes at være vigtigt i denne proces.
For at undgå organskader
Ifølge nogle undersøgelser er nitrit en kraftig hæmmer af skade på hjerte og lever i iskæmiske processer (nedsat blodgennemstrømning i en del af kroppen). Dette antages at skyldes, at det er en biologisk reserve af NO.
Det blev konkluderet, at det kan bruges til at forhindre organskader efter at have genoprettet blodgennemstrømningen, der er blevet afbrudt af et hjerteanfald, højrisiko abdominal kirurgi eller en organtransplantation..
For at undgå infektioner ved at bære kontaktlinser
NaNO er fundetto forhindrer dannelsen af film af patogene mikroorganismer Staphylococcus aureus Y Pseudomonas aeruginosa om kontaktlinser.

I forskellige anvendelser
Natriumnitrit bruges til at fremstille farvestoffer, stoffer og forskellige organiske forbindelser.
Fungerer også som korrosionshæmmer i universalfedt.
Risici eller ulemper
Et af problemerne med at bruge natriumnitrit til cyanidforgiftninger er, at det forårsager alvorlige hjerte-kar-lidelser hos børn..
Ikke anbefalet til brandofre, hvor samtidig eksponering for både cyanid og kulilte (CO) forekommer. CO reducerer blodets evne til at transportere ilt, så administration af NaNOto ville forværre den lave iltilstand i patientens blod.
Inhaleret natriumnitrit er irriterende og giftigt, det kan beskadige det kardiovaskulære system og centralnervesystemet. Derudover er det skadeligt for miljøet.
Natriumnitrit, der indtages med mad, kan være skadeligt. Når nitrit når maven, reagerer det med visse forbindelser, der danner nitrosaminer, som kan forårsage kræft.
Disse reaktioner kan undgås i nærværelse af C-vitamin.
Ifølge visse kilder, der er konsulteret, er risikoen for at indtage nitrit med saltet kød eller fisk minimal, fordi nitrit er naturligt til stede i spyt.
Kilderne indikerer, at denne risiko også er minimal sammenlignet med de store fordele ved at indtage mad fri for skadelige mikroorganismer.
Referencer
- Bhattacharya, R. og Flora, S.J.S. (2015). Cyanidtoksicitet og behandling deraf. I Handbook of Toxicology of Chemical Warfare Agents (Anden udgave). Gendannet fra sciencedirect.com.
- OS. National Library of Medicine. (2019). Natriumnitrit. Gendannet fra: pubchem.ncbi.nlm.nih.gov.
- Kim, D.J. et al. (2017). Antibiofilm-virkningen af nitrogenoxid på bløde kontaktlinser. BMC Ophthalmol 17, 206 (2017). Gendannet fra bmcophthalmol.biomedcentral.com.
- Ramis-Ramos, G. (2003). Antioxidanter. Syntetiske antioxidanter. I Encyclopedia of Food Sciences and Nutrition (Anden udgave). Gendannet fra sciencedirect.
- Barozzi Seabra, A. og Durán, N. (2017). Kvælstofoxiddonorer til behandling af forsømte sygdomme. I nitrogenoxiddonorer. Gendannet fra sciencedirect.com.
- Duranski, M.R. et al. (2005). Cytobeskyttende virkninger af nitrit under in vivo iskæmi-reperfusion af hjerte og lever. J Clin Invest 2005; 115 (5): 1232-1240. Gendannet fra ncbi.nlm.nih.gov.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.

Endnu ingen kommentarer