
Hvad er uorganiske kemiske funktioner?
Det uorganiske kemiske funktioner er de familier af uorganiske forbindelser, der har lignende kemiske egenskaber. Disse kemiske funktioner består af fem grupper: oxider, baser eller hydroxider, syrer, salte og hydrider..
Hver kemisk funktion er defineret af et sæt atomer, der identificerer dem. På denne måde bliver det muligt at identificere den funktion, som en kemisk forbindelse hører til i henhold til dens elementer..

I den forstand kan vi bekræfte, at OH-gruppen definerer den kemiske funktion af hydroxidet. Derfor vil NaOH (natriumhydroxid) tilhøre gruppen af hydroxider.
Uorganiske kemiske funktioner gør brug af kemiske forbindelser af mineralsk oprindelse. Salt, vand, guld, bly, gips og talkum er nogle eksempler på uorganiske forbindelser i daglig brug..
Alle uorganiske forbindelser har eksisteret på planeten jorden, før livet opstod. Med atomteori, udviklingen af det periodiske system og radiokemi, var det muligt at definere de fem funktioner i uorganisk kemi.
De første undersøgelser og tilgange til emnet fandt sted i begyndelsen af det 19. århundrede og var baseret på undersøgelsen af enkle uorganiske forbindelser (salte og gasser)..
Artikelindeks
- 1 Uorganiske kemiske funktioner
- 1.1 - Oxider
- 1.2 - Baser eller hydroxider
- 1.3 - Syrer
- 1.4 - Salte
- 1.5 - Hydrider
- 2 Referencer
Uorganiske kemiske funktioner
- Oxider

Oxider er dobbelt- eller binære forbindelser, hvor et eller flere iltatomer kombineres med andre grundstoffer. Af denne grund er der adskillige typer oxider i forskellige tilstande af stoffer (fast, flydende og luftformigt).
Oxygen bidrager altid med en oxidationstilstand på -2, og næsten alle de elementer, der kombineres med det, giver anledning til stabile forbindelser i forskellige grader af oxidation..
Takket være disse har de opnåede forbindelser forskellige egenskaber og kan have både kovalente og faste ionbindinger..
Grundlæggende oxider
Grundlæggende oxider er forbindelser afledt af blandingen af ilt med et metal (overgang, jordalkali eller alkalisk). For eksempel resulterer kombination af magnesium med ilt i en basisk oxid, som denne:
2Mg + O2 → 2 MgO
Metal + ilt = basisk oxid
2MgO = Grundlæggende oxid
Nomenklatur
Nomenklaturen for oxiderne er altid den samme. Først angives det generiske navn på forbindelsen (oxid), og senere skrives navnet på metallet. Dette sker, så længe metalens valens er fast.
Et eksempel kan være natriumoxid eller Na2O, hvor metalsymbolet går først og derefter det for ilt med dets valens eller oxidationstilstand på -2.
I tilfælde af basiske oxider er der tre typer nomenklatur: det traditionelle, det atomare og aktietallet. Navnet på hvert basisoxid vil afhænge af hvert elements valens eller oxidationsnummer.
Egenskaber
- De dannes altid ved at kombinere ethvert element med ilt.
- Binære oxider er dem, der opnås ved at blande ilt med et andet element.
- For at opnå et ternært eller blandet oxid skal en binær forbindelse kombineres med vand (H2O).
- Der er blandede oxider, der skyldes kombinationen af to forskellige grundstoffer med ilt.
- Baser eller hydroxider

Deres smag er bitter, deres tekstur er sæbevidende at røre ved, de er gode ledere med elektrisk strøm, når de er i en vandig opløsning, de er ætsende, og når de rører ved lakmuspapir, bliver de fra lyserøde til blå..
Egenskaber
- De stammer fra blandingen af en basisk oxid med vand.
- De stoffer, de skaber, kan modtage protoner.
- De er ledere af elektricitet kaldet elektrolytter.
- De er opløselige i vand, når de kommer i kontakt med det.
- Dens smag er bitter.
- De er ætsende for huden.
- Syrer

Syrer er uorganiske forbindelser, der skyldes blanding af brint med ethvert element eller en gruppe af grundstoffer med høj elektronegativitet.
De kan let identificeres ved deres sure smag, fordi de kan brænde huden, når de kommer i direkte kontakt med den, og på grund af deres evne til at ændre farven på lakmuspapir fra blå til lyserød..
Hydracids
Hydracider er en gruppe af syrer, der stammer fra kombinationen af hydrogen og et ikke-metal. Et eksempel kan være kombinationen af chlor og hydrogen, der resulterer i saltsyre, som denne:
Cl2 + H2 → 2HCL
Nonmetal + Hydrogen = Hydracid
H2CL = Hydracid
Oxacids
Oxacider er en gruppe af syrer, der stammer fra kombinationen af vand og en syreoxid. Et eksempel kan være kombinationen af svoveltrioxid med vand, der resulterer i svovlsyre, som denne:
SO3 + H2O → H2SO4
Syreoxid + vand = Oxacid
H2SO4 = Oxacid
Egenskaber
- De brænder huden, da de er ætsende.
- Dens smag er sur.
- De er ledere med elektrisk strøm.
- Når de reagerer med en base, danner de salt og vand.
- Når de reagerer med et metaloxid, danner de salt og vand.
- Du går ud
Salte er forbindelser, der stammer fra at kombinere en base med en syre. De har generelt en salt smag og er i en sur tilstand.
De er gode elektriske ledere i vandige opløsninger. Kontakt med lakmuspapir påvirker ikke dets farve.
Haloider
Haloidesalte er dem, der mangler ilt og dannes gennem følgende reaktioner:
1 - Når det blandes med et halogenmetal. Et eksempel kan være kombinationen af magnesium med saltsyre til dannelse af magnesiumchlorid og hydrogen, som dette:
Mg + 2HCl → MgCl2 + H2
2 - Ved blanding af et aktivt metal med et hydracid. Et eksempel kan være kombinationen af brombrintesyre og natriumoxid, hvilket resulterer i natriumbromid og vand som denne:
2HBr + 2NaO2 → NaBr + H2O
3 - Ved blanding af et hydracid med et metaloxid. Et eksempel kan være kombinationen af saltsyre med natriumhydroxid til dannelse af natriumchlorid og vand som denne:
HCI + NaOH → NaCl + H2O
- Oxisales

Oxysalte er de salte, der indeholder ilt. De dannes som følger:
1 - Ved blanding af en hydracid med en hydroxid. Dette er en neutraliseringsproces. Et eksempel kan være blandingen af magnesium med svovlsyre til dannelse af magnesiumsulfat og vand som denne:
Mg + H2SO4 → MgSO4 + H2O
2 - Ved blanding af en oxacid med et aktivt metal. Et eksempel kan være kombinationen af calciumhydroxid med kuldioxid for at give calciumcarbonat og vand som denne:
Ca (OH) 2 + CO2 → CaCO3 + H2O
3 - Ved blanding af et hydroxid med et anhydrid.
4 - Ved blanding af et hydroxid med en oxacid. Et eksempel kan være kombinationen af salpetersyre med bariumhydroxid for at give bariumnitrat og vand som denne:
2HNO3 + Ba (OH) 2 → Ba (NO3) 2 + 2H2O
Egenskaber
- De har en salt smag.
- De kan være sure eller basiske.
- De er gode elektriske ledere.
- Hydrider
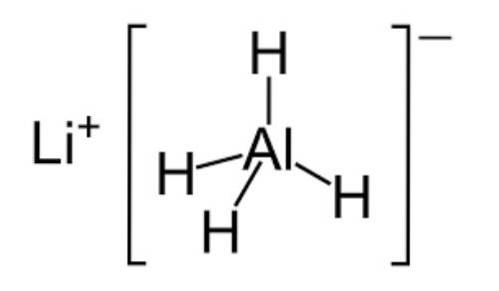
Hydrider er uorganiske kemiske forbindelser, der består af brint og ethvert ikke-metallisk element.
De er normalt i gasform og har egenskaber svarende til syrenes. Der er dog visse specielle hydrider såsom vand (H2O), der kan være i flydende tilstand ved stuetemperatur..
Nomenklatur
For at formulere et hydrid skal du først skrive symbolet for brint og derefter det for elementet.
For at navngive dem tilføjes suffikset uro og den ikke-metalliske rod, der specificerer tilstedeværelsen af brint. Nogle eksempler er følgende:
HF = hydrogenfluorid
HCI = hydrogenchlorid
HBr = hydrogenbromid
Referencer
- (21. november 2011). BuenasTareas.com. Hentet fra oxider, syrer, hydroxider, haloidsalte osv .: goodtasks.com.
- García, R. E. (2007). Uorganiske kemiske funktioner og dets nomenklatur. Redaktionelle trillas.
- House, J. E., & House, K. A. (2016). Beskrivende uorganisk kemi. London: Elsevier.
- Vasquez, L. N. og Blanco, W. Y. (25. april 2013). Kemi. Hentet fra oxider, hydroxider, syrer og salte: quimicanataliamywendyd.blogspot.com.
- Williams, A. (1979). En teoretisk tilgang til uorganisk kemi. Berlin: Springer - Verlag.

Endnu ingen kommentarer