
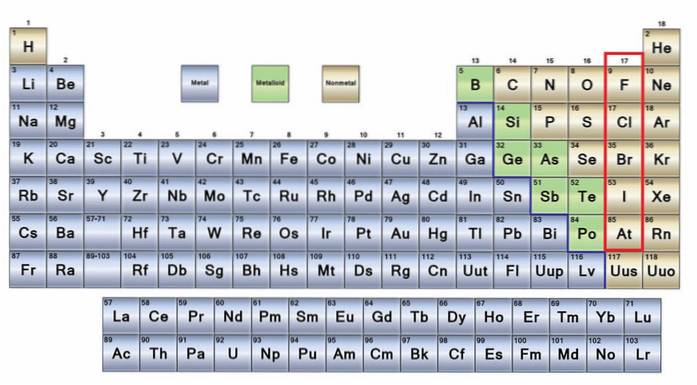
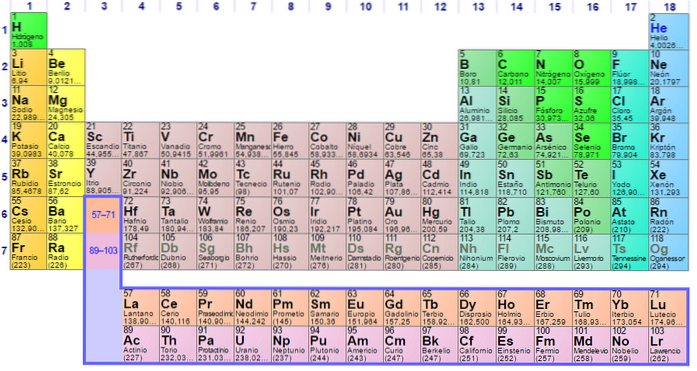
Ikke-metalhistorik, egenskaber, grupper, anvendelser
Det ingen metaller De er en gruppe af elementer, der er placeret på højre side af det periodiske system, med undtagelse af brint, der er placeret i gruppe 1 (IA) sammen med alkalimetalerne. Hvis du vil vide, hvad de er, skal du se i øverste højre hjørne af p-blokken.
Ikke-metalliske atomer er relativt små, og deres ydre elektroniske skal har et stort antal elektroner. Blandt de ikke-metalliske elementer kan være faste stoffer, væsker og gasser; skønt de fleste af dem er i luftform, beriger flere af dem atmosfæren.
En god del af ikke-metaller er til stede i alle levende væsener i form af forbindelser og makromolekyler. For eksempel: kulstof, ilt og brint er til stede i alle proteiner, lipider, kulhydrater og nukleinsyrer.
Fosfor er til stede i alle nukleinsyrer og i nogle kulhydrater og lipider. Svovl findes i mange proteiner. Kvælstof er en del af alle nukleinsyrer og proteiner.
På den anden side består underjordiske metangasser og råolie næsten udelukkende af ikke-metalliske grundstoffer. Faktisk giver kulbrinter (kulstof og brint) en idé om, hvor rigelige ikke-metaller er på trods af deres lavere antal grundstoffer i det periodiske system..
Artikelindeks
- 1 Historie
- 2 Fysiske og kemiske egenskaber
- 2.1 Fysik
- 2.2 Kemi
- 3 grupper af ikke-metaller og grundstoffer
- 3.1 Gruppe 1
- 3.2 Gruppe 14
- 3.3 Gruppe 15
- 3.4 Gruppe 16
- 3.5 Gruppe 17
- 3.6 Gruppe 18
- 4 anvendelser
- 4.1 Brint
- 4.2 Kulstof
- 4.3 Kvælstof
- 4.4 Fosfor
- 4.5 Oxygen
- 4.6 Svovl
- 4.7 Selen
- 4.8 Fluor
- 4.9 Klor
- 4.10 Brom
- 4.11 Jod
- 4.12 Helium
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 Referencer
Historie
Siden oldtiden (3750 f.Kr.) brugte egypterne kul til at reducere det kobber, der var til stede i deres mineraler, såsom korvellit og malakit.
I 1669 lykkedes det Hennin Brand at isolere fosfor fra opsamlet urin. Henry Cavendish (1776) lykkedes at identificere brint, skønt flere forskere, herunder Robert Boyle (1670), producerede brint ved at reagere en stærk syre med et metal.
Carl Scheele producerede ilt ved opvarmning af kviksølvoxid med nitrater (1771). Curtois formåede at isolere jod, mens han forsøgte at forberede saltpeter fra tang (1811). Balard og Gmelin isoleret brom (1825).
I 1868 opdagede Janssen og Lockger uafhængigt helium ved at observere en gul linje i studiet af spektret af sollys, der ikke tilhørte et andet element. Moissan lykkedes at isolere fluor (1886).
I 1894 opdagede Lord Rayleigh og Ramsey argon ved at undersøge kvælstofets egenskaber. Ramsay og Travers (1898) isolerede krypton, neon og xenon fra flydende argon ved kryogen destillation af luft..
Fysiske og kemiske egenskaber

Fysisk
Nogle af de fysiske egenskaber ved ikke-metaller er:
-De har lav elektrisk ledningsevne bortset fra kulstof i form af grafit, som er en god leder af elektricitet..
-De kan vises under det fysiske udseende af faste stoffer, væsker eller gasser.
-De har lav varmeledningsevne bortset fra kulstof i form af diamant, som ikke opfører sig som en termisk isolator..
-De har lav glans i modsætning til den metalliske glans af metaller.
-Ikke-metalliske faste stoffer er sprøde, så de ikke er duktile eller formbare.
-De har lave smelte- og kogepunkter.
-De kan have forskellige krystallinske strukturer. Således har phosphor, ilt og fluor en kubisk krystallinsk struktur; hydrogen, carbon og nitrogen, sekskantet; og svovl, chlor, brom og iod, orthorhombisk.
Kemi
Ikke-metal er kendetegnet ved at have en høj ioniseringsenergi og en høj elektronegativitetsværdi. Fluor har for eksempel den højeste elektronegativitet (3,98), der er det mest reaktive element i ikke-metaller.
Men overraskende har ædelgasserne helium (5.5) og neon (4.84) den højeste elektronegativitet. De er imidlertid kemisk inaktive, fordi de ydre elektroniske skaller er fyldt..
Ikke-metaller danner ioniske forbindelser med metaller og kovalente med ikke-metaller.
Ikke-metalliske grundstoffer findes i diatomiske molekyler, bundet af kovalente bindinger. I mellemtiden er atomer af ædle gasser i form af atomenheder.
De danner sure oxider, der, når de reagerer med vand, giver syrer.
Ikke-metalgrupper og -elementer
Gruppe 1
Det består af brint, en farveløs og lugtfri gas, diatomisk. Oxidationstilstand +1. Det har en lavere tæthed end luft. I fast tilstand har den en sekskantet krystallinsk struktur. Brint er et dårligt reaktivt element.
Gruppe 14
Kulstof er det eneste ikke-metal i denne gruppe. Kulstof i form af grafit er et skinnende fast stof med en sekskantet krystallinsk struktur. Det har en høj elektrisk ledningsevne. Dens mest almindelige oxidationstilstande er +2 og +4.
Gruppe 15
Kvælstof
Farveløs og lugtfri gas. Det er et let reaktivt element og lidt mere tæt end luft. Mest almindelige oxidationstilstande: -3 og +5. Danner diatomiske molekyler, Nto.
Match
Solid, farven kan være hvid, gul eller sort. Lidt reaktivt. Orthorhombisk krystalstruktur. Elektronegativitet 2.1. Mest almindelige oxidationstilstande: -3 og +5.
Gruppe 16
Ilt
Farveløs eller lyseblå gas, lugtfri. Generelt ikke-reaktivt. Kubisk krystalstruktur. Det er en isolator og et stærkt oxidationsmiddel. Elektronegativitet 3.5. Oxidationstilstand -2
Svovl
Strålende gult fast stof, skørt, moderat reaktivt. Orthorhombisk krystalstruktur. Danner kovalente bindinger. Elektronegativitet 2.5. Mest almindelige oxidationstilstande: -2, +2, +4 og +6.
Selen
Solid grå eller rødlig til sort. Gråt selen udviser lysfølsom elektrisk ledningsevne. Det er et blødt og sprødt fast stof. Elektronegativitet 2.4. Oxidationstilstande: -2, +2, +4 og +6.
Gruppe 17
Fluor
Det er en lysegul gas, meget giftig. Det er et meget reaktivt element. Det forekommer som diatomiske molekyler, Fto. I fast tilstand krystalliserer den i kubisk form. Elektronegativitet 3.98. Oxidationstilstande -1.
Klor
Det er en grøn-gul gas. Det præsenterer diatomiske molekyler, Clto. Det er meget reaktivt. I fast tilstand er den krystallinske struktur orthorhombisk. Elektronegativitet 3.0. Oxidationstilstande: - 1, +1, +3, +5, +7.
Brom
Det er en rødbrun væske. Elektronegativitet 2.8. Oxidationstilstande -1, +1, +3, +5 og +7.
Jod
Det er et sort fast stof, der udsendes en violet damp ved sublimering. Orthorhombisk krystalstruktur. Metaljodider er ioniske. Elektronegativitet 2.5. Oxidationstilstande: -1, +1, +3, +5 og +7.
Astatus
Det er en sort sort. Ansigtscentreret kubisk krystalstruktur. Elektronegativitet 2.2. Det er et svagt oxidationsmiddel.
Gruppe 18
Helium
Det har en høj varmeledningsevne. Elektronegativitet 5.5. Det er kemisk inert og ikke-brændbart. Lav densitet og høj fluiditet.
Neon
Høj kølekapacitet i flydende tilstand. Elektronegativitet 4,84. Det er den mindst reaktive af de ædle gasser.
Argon
Det er tættere end luft. Kemisk inert. Elektronegativitet 3.2.
Krypton
Elektronegativitet 2,94. Kan reagere med fluor til dannelse af kryptondifluorid (KrFto).
Xenon
Det krydser blod-hjerne-barrieren. Den reagerer på elektrisk strøm ved at producere lys. Elektronegativitet 2.2. Danner komplekser med fluor, guld og ilt.
Radon
Det er et radioaktivt element. Elektronegativitet 2.06. Danner forbindelser med fluor (RnFto) og med ilt (RnO3).
Ansøgninger
Brint
Det bruges i raketfremdrift og som brændstof i bilmotorer, der bruger brint. Det bruges til syntesen af ammoniak (NH3) og ved hydrogenering af fedtstoffer.
Kulstof

Grafit bruges til fremstilling af blyanter og højstyrkefibre, der bruges til fremstilling af sportsudstyr. Diamant bruges som en perle af stor værdi og i borehuller som slibemiddel. Kuldioxid anvendes til produktion af kulsyreholdige drikkevarer.
Kvælstof
Det bruges til produktion af ammoniak, salpetersyre og urinstof. Kvælstof er et essentielt element for planter og bruges til fremstilling af gødning.
Match
Hvidt fosfor bruges som et rodenticid, insekticid og i fyrværkeriindustrien. Rødt fosfor bruges til at fremstille tændstikker. Dens forbindelser bruges også til produktion af gødning.
Ilt
Ilt anvendes til fremstilling af stål, plast og tekstiler. Det bruges også til raketdrivmidler, iltterapi og vejrtrækningshjælp i fly, ubåde og rumfart..
Svovl
Det bruges som råmateriale til produktion af svovlsyre, krudt og til vulkanisering af gummi. Sulfitter bruges til blegning af papir og i fungicid.
Selen
Det bruges til at give glasset en skarlagenrød nuance. Det bruges også til at neutralisere det grønlige skær, der produceres ved forurening af glasset med jernforbindelser. Det bruges i fotoelektriske celler med anvendelse i døre og elevatorer.
Fluor

Det tilsættes til tandpastaer for at forhindre hulrum. Hydrogenfluorid anvendes som råmateriale til teflon. Monatomisk fluor anvendes til fremstilling af halvledere.
Klor
Det bruges i ekstraktionsmetallurgi og i klorering af carbonhydrider til fremstilling af forskellige produkter såsom PVC. Klor bruges i træmasse og blegemidler i tekstil. Det bruges også som et vanddesinfektionsmiddel.
Brom
Det bruges til fremstilling af sølvbromid til lysfølsomme linser og i fotografisk film. Det bruges også til fremstilling af det beroligende natriumbromid og dibromethan, en antiknokomponent af benzin.
Jod
Kaliumiodid (KI) tilsættes for at forhindre skjoldbruskkirtel. Tinktur af jod bruges som et antiseptisk middel og kimdræbende middel. Jod er en del af skjoldbruskkirtelhormonerne.
Helium
Det bruges til påfyldning af luftballoner og blandet med ilt til åndedræt i dybt vand. Det bruges til svejsning i en inert atmosfære og hjælper også med at opretholde meget lave temperaturer inden for forskning.
Neon
I glasrør, der er oplyst af virkningen af elektricitet (røde neonlys).
Argon
Bruges til at skabe en atmosfære til svejsning og til påfyldning af glødepærer.
Xenon
En blanding af xenon og krypton anvendes til fremstilling af højintensitetsblitz i korte fotografiske eksponeringer.
Radon
Det bruges til behandling af kræft tumorer ved strålebehandling.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. og Ahern, K. G. (2002). Biokemi. Tredje udgave. Redigere. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06. oktober 2019). Hvad er egenskaberne ved ikke-metaller? Gendannet fra: thoughtco.com
- Wikipedia. (2019). Ikke-metal. Gendannet fra: en.wikipedia.org
- Redaktørerne af Encyclopaedia Britannica. (5. april 2016). Ikke-metal. Encyclopædia Britannica. Gendannet fra: britannica.com
- José M. Gavira Vallejo. (2016, 27. januar). Hvad er de polygene elementer? Og icosagens, crystallógens, chalcogens ...? Gendannet fra: triplenlace.com


Endnu ingen kommentarer