
Pentanon kemiske struktur, egenskaber, syntese, anvendelser
Det pentanon er en organisk forbindelse, der tilhører ketonfamilien, hvis kemiske formel er C5H10O. Det er stadig en af de enkleste ketoner og består af en farveløs væske med en aroma, der ligner acetone. Fra dette punkt viser ketoner, med hensyn til kulstofantalet i deres skelet, isomerismeposition.
Når vi taler om positionisomerisme, henviser det til, hvor carbonylgruppen er, C = O. Således består pentanon faktisk af to forbindelser med fysiske egenskaber, der adskiller sig lidt fra hinanden: 2-pentanon og 3-pentanon (nederste billede). Begge er flydende, men deres kogepunkter er de samme, så de kan ikke adskilles ved destillation..
Hver af de to pentanoner har imidlertid sin egen syntetiske rute, så det er usandsynligt, at der er en blanding af dem; blanding, der muligvis kan adskilles ved frysning.
Deres anvendelse er især begrænset som organiske opløsningsmidler; alternativer til acetone i miljøer, hvor den anvendes ved en temperatur, der er højere end dens lave kogepunkt. Ligeledes er de udgangsmaterialer til andre organiske synteser, da deres C = O-gruppe kan reduceres eller gennemgå nukleofil tilsætning..
Artikelindeks
- 1 Kemisk struktur
- 1.1 Positionsisomerer
- 1.2 Intermolekylære interaktioner
- 1.3 Krystaller
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Molær masse
- 2.3 Densitet
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Opløselighed i vand
- 2.7 Damptryk
- 2.8 Flammepunkt
- 2.9 Stabilitet
- 3 Syntese
- 3.1 2-pentanon
- 3,2 3-pentanon
- 4 anvendelser
- 5 Referencer
Kemisk struktur
Positionsisomerer
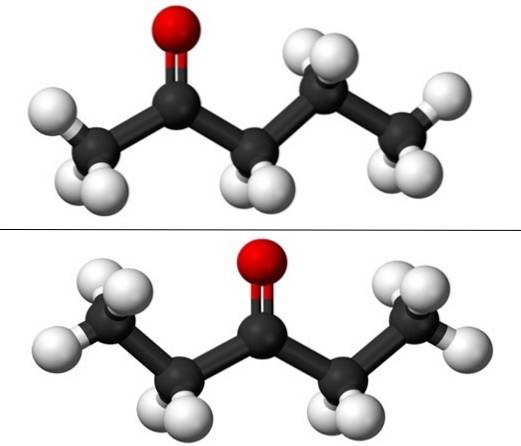
På billedet har vi de molekylære strukturer af de to positionelle isomerer for pentanon, repræsenteret af en model af kugler og søjler. De sorte kugler svarer til kulstofskeletterne, de hvide til hydrogenatomerne, og de røde til iltatomerne i C = O-gruppen..
2-pentanon
2-pentanon (ovenfor) har gruppen C = O i det andet carbon, hvilket svarer til det, hvis det var i det fjerde; 2-pentanon og 4-pentanon er ækvivalente, da det er nok at rotere dem 180 °, så deres strukturer er de samme.
Til venstre for C = O er en methylgruppe, CH3-, og til højre for ham en propylradikal. Derfor kaldes denne keton også (mindre almindeligt anvendt) methylpropylketon (MPK). Du kan se asymmetrien af denne struktur ved første øjekast.
3-pentanon
3-pentanon (nederst) har gruppen C = O på det tredje carbon. Bemærk, at denne isomer er en større version af acetone, og at den også er meget symmetrisk; de to radikaler på siderne af C = O-gruppen er ens: to ethylradikaler, CH3CHto-. Derfor kaldes 3-pentanon også diethylketon (eller dimethylaceton).
Intermolekylære interaktioner
Tilstedeværelsen af carbonylgruppen, både i 2-pentanon og 3-pentanon, giver molekylet polaritet.
Derfor er begge isomerer af pentanon i stand til at interagere med hinanden gennem dipol-dipolkræfter, hvor den højeste densitet af negativ ladning, δ-, set i et elektrostatisk potentialkort, vil blive orienteret omkring iltatomet..
Ligeledes intervenerer Londons dispersionskræfter i mindre grad mellem de forkullede og hydrogenerede skeletter..
Da pentanon har et større molekylært areal og masse sammenlignet med acetone, tilføjer dette bidrag sit dipolmoment og giver det mulighed for at have et højere kogepunkt (102 ºC> 56 ºC). Faktisk fordamper de to isomerer ved 102 ° C; mens det fryser ved forskellige temperaturer.
Krystaller
Sandsynligvis spiller symmetrier en vigtig rolle i krystallisering. For eksempel er smeltepunktet for 2-pentanon -78 ° C, mens det for 3-pentanon, -39 ° C.
Dette betyder, at 3-pentanonkrystaller er mere stabile over for temperatur; dens molekyler er mere sammenhængende og kræver mere varme for at separere i væskefasen.
Hvis der var en blanding af begge isomerer, ville 3-pentanon være den første til at krystallisere, idet 2-pentanon var sidst ved en lavere temperatur. De mere symmetriske 3-pentanonmolekyler orienterer sig lettere end dem af 2-pentanon: asymmetriske og på samme tid mere dynamiske.
Ejendomme
Fysisk fremtoning
Farveløse væsker med en aroma svarende til acetone.
Molar masse
86,13 g / mol
Massefylde
0,81 g / ml (3-pentanon)
0,809 g / ml (2-pentanon)
Smeltepunkt
-78 ºC (2-pentanon)
-39 ºC (3-pentanon)
Kogepunkt
102 ºC (for begge isomerer)
Vandopløselighed
35 g / l (3-pentanon)
60 g / l (2-pentanon)
Damptryk
35 mmHg (3-pentanon)
270 mmHg (2-pentanon) ved 20 ° C
Disse værdier er ikke nyttige til direkte sammenligning af begge isomers damptryk, da den første rapporteres uden den temperatur, ved hvilken den blev målt..
Flammepunkt
12,78 ° C (3-pentanon)
10 ºC (2-pentanon)
Stabilitet
De to isomerer af pentanon er ekstremt brandfarlige, så de skal holdes så langt væk fra enhver varmekilde som muligt. Flammepunkterne indikerer, at en flamme kan antænde dampene fra begge pentanoner selv ved en temperatur på 10 ° C..
Syntese
Selvom de to isomerer af pentanon er fysisk og kemisk meget ens, er deres syntetiske ruter uafhængige af hinanden, så det er usandsynligt, at begge opnås i samme syntese.
2-pentanon
Med udgangspunkt i reagenset 2-pentanol, en sekundær alkohol, kan det oxideres til 2-pentanon ved anvendelse af hypochlorsyre dannet in situ, HClO, som et oxidationsmiddel. Oxidationen ville være:
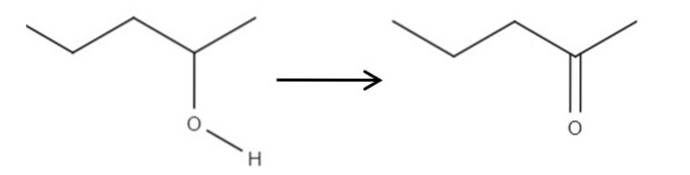
Simpelthen bliver C-OH-bindingen C = O. Der er andre metoder til at syntetisere 2-pentanon, men af alt dette er det nemmest at forstå..
3-pentanon
3-pentanon kan syntetiseres ved keton-decarboxylering af propansyre, CH3CHtoCOOH. Denne syntetiske vej producerer symmetriske ketoner og består af et molekyle af CH3COOH mister COOH-gruppen som COto, mens den anden er dens OH-gruppe i form af HtoELLER:
2CH3CHtoCOOH => CH3CHtoBiltoCH3 + COto + HtoELLER
En anden noget mere kompleks vej er at reagere direkte på en blanding af ethylen, CHto= CHto, COto og Hto til dannelse af 3-pentanon.
Ansøgninger
Medmindre anvendelsen er meget streng, er det en specifik syntese, eller det er også blevet vist, at de to isomerer ikke producerer de samme resultater, det er irrelevant at vælge mellem at bruge 2-pentanon eller 3-pentanon til nogen af deres anvendelser..
Med andre ord, "det betyder ikke noget", om du vil bruge 2-pentanon eller 3-pentanon som opløsningsmiddel til maling eller harpiks eller som affedtningsmiddel, da de vigtigste kriterier er dets pris og tilgængelighed. 3-pentanon bruges i bilindustrien til at undersøge gassernes adfærd i forbrændingsmotorer.
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Wikipedia. (2019). 3-Pentanon. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). 2-Pentanon. PubChem-database. CID = 7895. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2019). 3-Pentanon. Gendannet fra: chemspider.com
- Professor T. Nalli. (2013). Oxidation af 2-pentanol og destillation af produktet. Gendannet fra: course1.winona.edu



Endnu ingen kommentarer